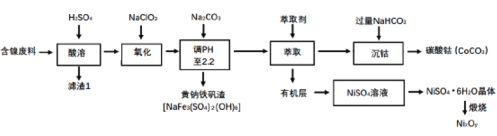
题目内容
【题目】25℃时,将浓度均为0.1 molL-1、体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液的pH的关系如图所示。下列说法正确的是( )

A.Ka(HA)=10-6B.b点时,c(B+)+c(HA)=0.05mol/L
C.c点时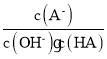 随温度升高而增大D.a→c过程中水的电离程度始终增大
随温度升高而增大D.a→c过程中水的电离程度始终增大
【答案】B
【解析】
根据图知,0.1mol/L酸溶液的pH=3,则c(H+)<0.1mol/L,说明HA是弱酸;0.1mol/L碱溶液的pH=11,c(OH-)<0.1mol/L,则BOH是弱碱;
A.由图可知 0.1molL-1HA 溶液pH=3,由 HAH++A-可知:Ka=  =
=![]() =10-5,选项A错误;
=10-5,选项A错误;
B. b点是两者等体积混合溶液呈中性,所以离子浓度的大小为:c(B+)=c(A)>c(H+)=c(OH),再根据物料守恒有c(A)+c(HA)=0.05mol/L,则c(B+)+c(HA)=0.05mol/L,选项B正确;
C.c点时,A-的水解平衡常数Kh= ,升高温度Kh增大,则
,升高温度Kh增大,则 减小,选项C错误;
减小,选项C错误;
D.a→b是酸过量和b→c 是碱过量,酸、碱对水的电离平衡起抑制作用,可水解的盐对水的电离平衡起促进作用,b点是弱酸弱碱盐水解对水的电离起促进作用,所以a→c 过程中水的电离程度先增大后减小,选项D错误。
答案选B。

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目