题目内容
物质A~H是我们熟悉的单质或化合物,其中A、F为金属单质,A在空气中燃烧生成淡黄色固体,F合金的用量是金属中最大的.C、D为气态非金属单质,D呈黄绿色.G的水溶液呈浅绿色,在适当的条件下它们之间可以发生如下图所示的转化(部分产物被略去).试回答下列问题:

(1)E的化学式为 ;D与F反应的化学方程式是 ;
(2)A在空气中燃烧的化学方程式是 ;
(3)A与水反应的离子方程式是 ;F与高温水蒸气反应的化学方程式是 ;
(4)写出G溶液中滴加B溶液后观察到的现象 .

(1)E的化学式为
(2)A在空气中燃烧的化学方程式是
(3)A与水反应的离子方程式是
(4)写出G溶液中滴加B溶液后观察到的现象
考点:无机物的推断
专题:推断题
分析:分析转化关系图,其中A、F为金属单质,A在空气中燃烧生成淡黄色固体判断为Na,F合金的用量是金属中最大的为Fe.C、D为气态非金属单质,D呈黄绿色判断为Cl2.G的水溶液呈浅绿色判断为亚铁盐溶液;结合转化关系分析推断,B为NaOH,C为H2,E为HCl,G为FeCl2,则F为Fe,H为氯化亚铁溶液和氢氧化钠溶液的反应生成氢氧化亚铁白色沉淀,依据推断分析回答问题.
解答:
解:由转化关系图及A、F为金属单质,A在空气中燃烧生成淡黄色固体判断A为Na,F合金的用量是金属中最大的为Fe.C、D为气态非金属单质,D呈黄绿色判断为Cl2.G的水溶液呈浅绿色判断为亚铁盐溶液;结合转化关系分析推断,B为NaOH,C为H2,E为HCl,G为FeCl2,则F为Fe,H为氯化亚铁溶液和氢氧化钠溶液的反应生成氢氧化亚铁白色沉淀,
(1)E为氯化氢,化学式为:HCl,D与F反应的化学方程式是2Fe+3Cl2=2FeCl3,
故答案为:HCl;2Fe+3Cl2=2FeCl3;
(2)A为金属钠在空气中燃烧的化学方程式是2Na+O2
Na2O2;
故答案为:2Na+O2
Na2O2;
(3)A为Na与水反应的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,F与高温水蒸气反应的化学方程式是3Fe+4H2O
Fe3O4+4H2,
故答案为:2Na+2H2O=2Na++2OH-+H2↑;3Fe+4H2O
Fe3O4+4H2;
(4)G溶液中滴加B溶液是氯化亚铁溶液中滴入氢氧化钠溶液反应生成白色氢氧化亚铁沉淀,在空气中迅速变化为灰绿色,最后变化为红褐色氢氧化铁沉淀;观察到的现象,先生成白色沉淀,很快变成灰绿色,最终变成红褐色;
故答案为:先生成白色沉淀,很快变成灰绿色,最终变成红褐色.
(1)E为氯化氢,化学式为:HCl,D与F反应的化学方程式是2Fe+3Cl2=2FeCl3,
故答案为:HCl;2Fe+3Cl2=2FeCl3;
(2)A为金属钠在空气中燃烧的化学方程式是2Na+O2
| ||
故答案为:2Na+O2
| ||
(3)A为Na与水反应的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,F与高温水蒸气反应的化学方程式是3Fe+4H2O
| ||
故答案为:2Na+2H2O=2Na++2OH-+H2↑;3Fe+4H2O
| ||
(4)G溶液中滴加B溶液是氯化亚铁溶液中滴入氢氧化钠溶液反应生成白色氢氧化亚铁沉淀,在空气中迅速变化为灰绿色,最后变化为红褐色氢氧化铁沉淀;观察到的现象,先生成白色沉淀,很快变成灰绿色,最终变成红褐色;
故答案为:先生成白色沉淀,很快变成灰绿色,最终变成红褐色.
点评:本题考查了物质转化关系和物质性质的分析判断,主要是钠、铁及其化合物性质的分析应用,掌握基础是关键,题目难度中等.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
| 物质编号 | 物质转化关系 | a | b | c | d |
| 1 | 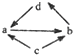 | FeCl2 | FeCl3 | Fe | CuCl2 |
| ② | NO | NO2 | O2 | HNO3 | |
| ③ | CH2=CH2 | CH3-CH3 | HC≡CH | CH3CH2Cl | |
| ④ | Al2O3 | NaAlO2 | Al | Al(OH)3 |
| A、①②③④ | B、①②③ |
| C、①③④ | D、②④ |
已知卤代烃能发生下列反应:2CH3CH2Br+2Na-→CH3CH2CH2CH3+2NaBr.下列有机物可一步合成环丙烷( )的是( )
)的是( )
 )的是( )
)的是( )| A、CH3CH2CH2Br |
| B、CH3CHBrCH2Br |
| C、CH2BrCH2CH2Br |
| D、CH3CHBrCH2CH2Br |
 利用常温下氨气与氯气能发生置换反应的性质,在氯碱工业生产中用氨来检查氯气是否泄漏,其模拟装置如图.下列有关说法不正确的是( )
利用常温下氨气与氯气能发生置换反应的性质,在氯碱工业生产中用氨来检查氯气是否泄漏,其模拟装置如图.下列有关说法不正确的是( )| A、烧瓶中会出现白烟 |
| B、烧瓶中会立即出现喷泉 |
| C、烧瓶中发生的反应表明常温下氨气有还原性 |
| D、烧瓶内氨气与氯气发生的反应中,氧化剂与还原剂物质的量之比是3:2 |
下列有关化学用语表示错误的是( )
| A、HCN的结构式:H-C≡N |
B、HClO的电子式为: |
C、HOCH2COOH缩聚物的结构简式: |
D、2-氯甲苯的结构简式: |
