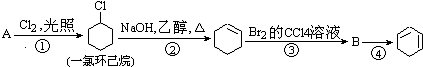
题目内容
【题目】下列关于胶体的叙述中,不正确的是
A.胶体是一种混合物
B.用丁达尔现象可区分Fe(OH)3胶体、水、CuSO4溶液
C.用过滤器可以将胶体和溶液分开
D.可见光透过胶体时发生丁达尔现象
【答案】C
【解析】
A.液溶胶属于胶体的一种,是一种液态混合物,气溶胶为气体如空气,所以胶体不一定为液态,属于分散系的一种,故不选A;
B.用丁达尔效应可区分胶体和溶液,可以鉴别出Fe(OH)3胶体,水、CuSO4溶液利用颜色区别,故不选B;
C.胶体分散质微粒直径太小,用过滤器不可以将胶体和溶液分开,可以用半透膜分离胶体和溶液,故选C;
D.可见光透过胶体时发生丁达尔现象,故不选D;
答案:C

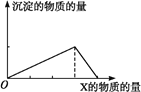
【题目】将物质X逐渐加入(或通入)Y溶液中,其生成沉淀的量与加入X的物质的量的关系如下图所示,符合图示情况的是( )
| A | B | C | D |
X | CO2 | HCl | NaOH | AlCl3 |
Y | Ca(OH)2 | NaAlO2 | AlCl3 | NaOH |
A. A B. B C. C D. D
【题目】常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表所示:
实验编号 | HA物质的量浓度(mol*L﹣1) | NaOH物质的量浓度(mol*L﹣1) | 混合溶液的pH |
① | 0.1 | 0.1 | pH=9 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.1 | pH<7 |
请回答:
(1)从①组情况表明,HA是(填“强酸”或“弱酸”).
(2)②组情况表明,c0.2(选填“大于”、“小于”或“等于”).混合液中离子浓度c(A﹣)与c(Na+)的大小关系是 .
(3)从③组实验结果分析,说明HA的电离程度NaA的水解程度(选填“大于”、“小于”或“等于”),该混合溶液中离子浓度由大到小的顺序是 .
(4)①组实验所得混合溶液中由水电离出的c(OH﹣)与溶液中的c(OH﹣)之比为 . 写出该混合溶液中下列算式的精确结果(不能近似计算):c(Na+)﹣c(A﹣)=molL﹣1 .