题目内容
14g的FeS跟足量的稀盐酸反应,把生成的气体通入200mL的2mol/L的NaOH溶液中,气体全部被吸收,通过计算说明生成物是什么?
答案:
解析:
解析:
|
解:设生成x mol FeS+2HCl= NaOH:2×0.2=0.4(mol) 所以 NaOH的物质的量> NaOH∶ NaOH∶ NaOH∶ 答:生成物为 |

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
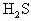 气体
气体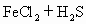
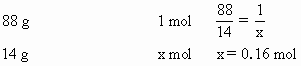
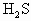 :0.16 mol
:0.16 mol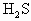 的物质的量
的物质的量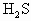 =1∶1为酸式盐
=1∶1为酸式盐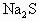 硫化钠.
硫化钠.