题目内容
14.下列化学用语书写正确的是( )| A. | 氯原子的结构示意图: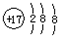 | B. | 氯化铵的电子式: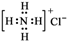 | ||
| C. | CO2的结构式:O=C=O | D. | CH4的比例模型: |
分析 A.氯原子的核电荷数、核外电子数都是17,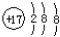 为氯离子结构示意图;
为氯离子结构示意图;
B.氯化铵为离子化合物,铵根离子和氯离子都需要标出最外层电子;
C.二氧化碳为直线形结构,分子中存在两个碳氧双键;
D. 为球棍模型,甲烷为正面体结构,由原子相对大小表示空间结构为比例模型.
为球棍模型,甲烷为正面体结构,由原子相对大小表示空间结构为比例模型.
解答 解:A.氯原子的核外电子数为17,最外层为7个电子,其正确的原子结构示意图为: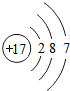 ,故A错误;
,故A错误;
B.氯化铵是由NH4+和Cl-离子构成,氯离子需要标出最外层电子,氯化铵正确的电子式为: ,故B错误;
,故B错误;
C.二氧化碳分子中含有两个碳氧双键,则CO2的结构式为:O=C=O,故C正确;
D.甲烷为正面体结构,由原子相对大小表示空间结构为比例模型, 是甲烷的球棍模型,CH4分子正确的比例模型为:
是甲烷的球棍模型,CH4分子正确的比例模型为: ,故D错误;
,故D错误;
故选C.
点评 本题考查了原子结构示意图、电子式、结构式及比例模型与球棍模型等知识,题目难度中等,注意掌握常见化学用语的概念及书写原则,明确球棍模型与比例模型的区别,试题侧重考查学生规范答题的能力.

练习册系列答案
相关题目
5.100mL 2mol/L的硫酸和过量的锌反应,为了加快反应速率,但又不影响生成氢气的总量,可以采取的措施是( )
| A. | 升高温度 | B. | 加入少量的Na2SO4溶液 | ||
| C. | 改用纯度高的锌粒 | D. | 改用小颗粒的锌粒 |
19.心酮胺是治疗冠心病的药物,它具有如下结构简式.下列关于心酮胺的叙述错误的是( )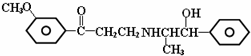
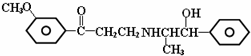
| A. | 可以发生加成反应 | B. | 可以发生消去反应 | ||
| C. | 可以发生银镜反应 | D. | 可以发生酯化反应 |
6.短周期主族元素A、B、C、D,原子序数依次增大.A、C的原子序数的差为8,A、B、C三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半.下列叙述正确的是( )
| A. | 单质B常温下能溶于浓硝酸 | |
| B. | A的氢化物沸点高于C的氢化物,因为A的非金属性比C强 | |
| C. | C、D形成的化合物CD2分子中各原子都满足8电子稳定结构 | |
| D. | 元素A与C形成的化合物CA2的水溶液中通入D单质充分反应后,溶液酸性减弱 |
3.下列叙述与蛋白质或糖类物质性质有关,并正确的是( )
| A. | 苯酚溶液不慎沾到皮肤上,立即用酒精溶液洗涤 | |
| B. | 任何条件下,稻草不可能转变为葡萄糖或酒精 | |
| C. | 氯化汞(HgCl2)的稀溶液不可用于手术器械消毒,因为它会使人体蛋白质变性 | |
| D. | 浓HNO3溅在皮肤上,使皮肤呈黄色,是由于浓HNO3和蛋白质发生颜色反应 |
4.在常温常压下,等物质的量的下列物质完全燃烧,消耗氧气最多的是( )
| A. | 甲烷 | B. | 乙醇 | C. | 苯 | D. | 乙酸乙酯 |