题目内容
【题目】综合利用CO2对环境保护及能开发意义重大。
(1)Li2O、Na2O、MgO均能吸收CO2。如果寻找吸收CO2的其他物质,下列建议合理的是______________。
a. 可在碱性氧化物中寻找
b. 可在ⅠA、ⅡA族元素形成的氧化物中寻找
c. 可在具有强氧化性的物质中寻找
(2)Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2。原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是__________________________。
(3)利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A:CO2+H2O![]() CO+H2+O2,已知:
CO+H2+O2,已知:
反应A的热化学方程式是___________________________。用稀氨水喷雾捕集CO2最终可得产品NH4HCO3.在捕集时,气相中有中间体NH2COONH4(氨基甲酸铵)生成.现将一定量纯净的氨基甲酸铵置于恒容的密闭真空容器中,分别在不同温度下进行反应:NH2COONH4(s)![]() 2NH3(g)+CO2(g).实验测得的有关数据见上表.( t1<t2<t3)氨基甲酸铵分解反应是________反应(“放热”、“吸热”).在15℃,此反应的化学平衡常数为:__________.
2NH3(g)+CO2(g).实验测得的有关数据见上表.( t1<t2<t3)氨基甲酸铵分解反应是________反应(“放热”、“吸热”).在15℃,此反应的化学平衡常数为:__________.

(4)高温电解技术能高效实现(3)中反应A,工作原理示意图如下:

① 电极b发生______________(填“氧化”或“还原”)反应。
② CO2在电极a放电的反应式是___________________________。
【答案】a、b CO2 + Li4SiO4 ![]() Li2CO3 + Li2SiO3 CO2(g) + H2O(g) = CO(g) + H2(g) +O2(g) ΔH = +524.8 kJ·mol-1 吸热 4×10﹣6 氧化 CO2 + 2e- = CO + O2-
Li2CO3 + Li2SiO3 CO2(g) + H2O(g) = CO(g) + H2(g) +O2(g) ΔH = +524.8 kJ·mol-1 吸热 4×10﹣6 氧化 CO2 + 2e- = CO + O2-
【解析】
(1)二氧化碳为酸性气体,Li2O、Na2O、MgO均能吸收CO2与氧化性无关,据此解题;
(2)在500℃,CO2与Li4SiO4接触后生成Li2CO3和另一种盐,该盐为Li2SiO3,据此书写反应原理方程式;
(3)根据图示反应Ⅰ和反应Ⅱ书写热化学反应方程式,构造目标方程式利用盖斯定律解答;
(4)根据表中温度对生产气体的浓度的影响分析;根据表中数据结合平衡常数的表达式求出反应NH2COONH4(s)2NH3(g)+CO2(g)的平衡常数;
(5)电极b氧离子失去电子发生氧化反应生成氧气;二氧化碳、水分别在a极得到电子发生还原反应生成一氧化碳、氢气,同时生成氧离子;
(1)a. Li2O、Na2O、MgO均属于碱性氧化物,均能吸收酸性氧化物CO2,可在碱性氧化物中寻找吸收CO2的其他物质,故a项正确;
b. Li2O、Na2O、MgO均能吸收CO2,钠、镁为ⅠA、ⅡA族元素,所以可在ⅠA和ⅡA族元素形成的氧化物中寻找吸收CO2的其他物质,故b项正确;
c. Li2O、Na2O、MgO均能吸收CO2,但它们都没有强氧化性,且吸收二氧化碳与氧化还原无关,故c项错误;
故答案为:a、b;
(2)在500℃,CO2与Li4SiO4接触后生成Li2CO3,反应物为CO2与Li4SiO4,生成物有Li2CO3,根据质量守恒可知产物还有Li2SiO3,所以化学方程式为:CO2+Li4SiO4![]() Li2CO3+Li2SiO3,
Li2CO3+Li2SiO3,
故答案为:CO2+Li4SiO4![]() Li2CO3+Li2SiO3;
Li2CO3+Li2SiO3;
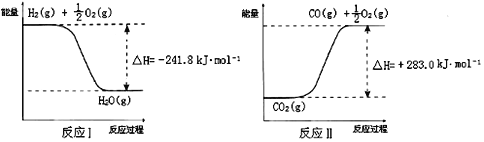
(3)根据图像可知,反应I的热化学方程式可表示为:H2(g) + ![]() O2(g) = H2O(g) ΔH = -241.8 kJ·mol-1 ①,同理可得反应II的热化学方程式可表示为:CO2(g) = CO(g) +
O2(g) = H2O(g) ΔH = -241.8 kJ·mol-1 ①,同理可得反应II的热化学方程式可表示为:CO2(g) = CO(g) +![]() O2(g) ΔH = +283.0 kJ·mol-1 ②,则根据盖斯定律可知, ②-①得CO2(g) + H2O(g) = CO(g) + H2(g) +O2(g),其反应热ΔH = +283.0 kJ·mol-1-(-241.8 kJ·mol-1)= +524.8 kJ·mol-1,则反应A的热化学方程式为:CO2(g) + H2O(g) = CO(g) + H2(g) +O2(g) ΔH = +524.8 kJ·mol-1,
O2(g) ΔH = +283.0 kJ·mol-1 ②,则根据盖斯定律可知, ②-①得CO2(g) + H2O(g) = CO(g) + H2(g) +O2(g),其反应热ΔH = +283.0 kJ·mol-1-(-241.8 kJ·mol-1)= +524.8 kJ·mol-1,则反应A的热化学方程式为:CO2(g) + H2O(g) = CO(g) + H2(g) +O2(g) ΔH = +524.8 kJ·mol-1,
故答案为:CO2(g) + H2O(g) = CO(g) + H2(g) +O2(g) ΔH = +524.8 kJ·mol-1;
(4)从表中数据可以看出,随着温度升高,气体的总浓度增大,平衡正向移动,则该反应为吸热反应;从反应NH2COONH4(s)![]() 2NH3(g)+CO2(g)可知,氨气与二氧化碳按物质的量之比为2:1生成,表中显示在15℃、t2时达到平衡,气体总浓度为3×102 mol/L,则c(NH3) = 3×102 mol/L×
2NH3(g)+CO2(g)可知,氨气与二氧化碳按物质的量之比为2:1生成,表中显示在15℃、t2时达到平衡,气体总浓度为3×102 mol/L,则c(NH3) = 3×102 mol/L×![]() = 2×102 mol/L,c(CO2) = 3×102 mol/L×
= 2×102 mol/L,c(CO2) = 3×102 mol/L×![]() = 1×102 mol/L,所以K=c2(NH3)×c(CO2) = (2×102 mol/L)2×1×102 mol/L = 4×106,
= 1×102 mol/L,所以K=c2(NH3)×c(CO2) = (2×102 mol/L)2×1×102 mol/L = 4×106,
故答案为:吸热;4×106;
(5)①CO2+H2O![]() CO+H2+O2,反应物中的氧元素化合价升高,被氧化,失去电子发生氧化反应在电极b附近生成氧气,即电极b发生氧化反应;
CO+H2+O2,反应物中的氧元素化合价升高,被氧化,失去电子发生氧化反应在电极b附近生成氧气,即电极b发生氧化反应;
故答案为:氧化;
②二氧化碳在a极得到电子,发生还原反应生成一氧化碳同时生成氧离子,反应电极反应式为CO2+2e-═CO+O2-,
故答案为:CO2+2e-═CO+O2-。

 阅读快车系列答案
阅读快车系列答案