题目内容
【题目】侯氏制碱法制得的NaHCO3固体中含有部分Na2CO3·nH2O(n<10)。取该固体8.50g充分加热,产生的气体依次通过浓硫酸(增重1.44 g)和碱石灰(增重1.76 g)。
请计算:
(1)固体中NaHCO3的质量为_________g。
(2)固体中Na2CO3·nH2O的n值为 ___________。
【答案】 6.72 4
【解析】(1)碱石灰增重1.76 g,则n(CO2)=0.04mol,NaHCO3固体受热发生反应:2NaHCO3![]() Na2CO3+ H2O+ CO2↑ ,根据方程式由CO2的量可知n(NaHCO3)=0.08mol、NaHCO3的质量为6.72 g,答案为6.72g
Na2CO3+ H2O+ CO2↑ ,根据方程式由CO2的量可知n(NaHCO3)=0.08mol、NaHCO3的质量为6.72 g,答案为6.72g
(2) 8.50g该固体含有Na2CO3·nH2O的质量为:1.78g,浓硫酸增重1.44 g,则n(H2O)=0.08mol;由方程式2NaHCO3![]() Na2CO3+ H2O+ CO2↑可知NaHCO3受热分解产生的水为:n1(H2O)=0.04mol,则由Na2CO3·nH2O固体受热发生反应:Na2CO3·nH2O
Na2CO3+ H2O+ CO2↑可知NaHCO3受热分解产生的水为:n1(H2O)=0.04mol,则由Na2CO3·nH2O固体受热发生反应:Na2CO3·nH2O![]() Na2CO3+ nH2O产生的水为:n2(H2O)=0.04mol,所以
Na2CO3+ nH2O产生的水为:n2(H2O)=0.04mol,所以![]() 解得n=4,答案为:4
解得n=4,答案为:4

【题目】下表是实验室制备气体的有关内容:
编号 | 实验内容 | 实验原理 | 气体发生装置 |
① | 制氧气 | H2O2―→O2 | |
② | 制氨气 | NH4Cl―→NH3 | |
③ | 制氯气 | HCl―→Cl2 |
(1)上表气体中:从制备过程看,必须选择合适的氧化剂才能实现的是____填气体的化学式,下同);从反应原理看,明显不同于其他两种气体的是________。
(2)根据表中所列实验原理,从下列装置中选择合适的气体发生装置,将其编号填入上表中的空格中_______。
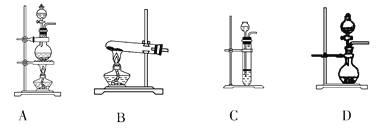
(3)若用上述制备O2的装置制备NH3,则选择的试剂为________________。
(4)制备Cl2需用8 mol·L-1的盐酸100 mL,现用12 mol·L-1的盐酸来配制。
①为提高配制的精确度,量取浓盐酸的仪器可选用下列中的______填序号):

②配制过程中,除上图所列仪器外,还需要的仪器有________、________、______。
【题目】氨基磺酸镍[Ni(H2NSO3)2]是工业电镀镍所必需的化工原料,某科研小组先用尿素、SO3合成中间体氨基磺酸(H2NSO3H),再用氨基磺酸、金属镍和双氧水反应来合成氨基磺酸镍。已知磺化制氨基磺酸反应原理和整个过程的流程图如下:
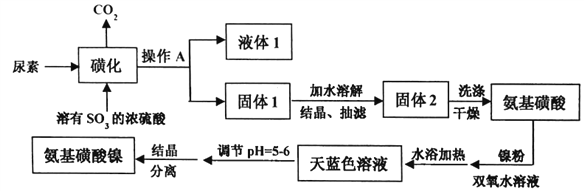
①CO(NH2)2(s)+SO3(g)→H2NCONHSO3H(s) △H<0
②H2NCONHSO3H (s)+ H2SO4→2H2NSO3H (s)+ CO2↑
已知物质的部分性质如下:
物质 | 溶解性 | 稳定性 | 酸碱性 |
氨基磺酸 | 溶于水、不溶于乙醇 | pH较低时发生水解生成NH4HSO4 | 强酸性 |
氨基磺酸镍 | 溶于水、乙醇 | 高于110℃时分解 | 酸性 |
请回答
(1)操作A的名称是_________液体1的主要成分是_______(填化学式)。
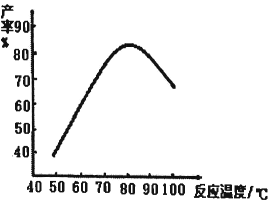
(2)“磺化”过程的温度与产率的关系如下图。温度高于80℃时氨基磺酸的产率会降低,原因一是升高温度平衡逆向移动,原因二是__________。
(3)写出制备氨基磺酸镍的化学方程式____________________。
(4)写出固体2洗涤的操作过程___________________。
(5)流程图中“天蓝色溶液”需要调节pH=5~6的原因是___________。

