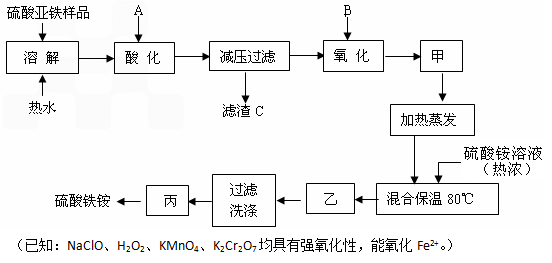
题目内容
某硫酸铵样品,测得其中氮元素的质量分数为20%,其样品中可能含有的另一种氮肥是
- A.CO(NH2)2(尿素)
- B.NH4HCO3
- C.NH4NO3
- D.NH4Cl
B
四种化肥的含氮量为:(NH4)2SO4中w(N)=28/132=21.2%
CO(NH2)2中w(N)=28/60=46.7%
NH4HCO3中w(N)=14/79=17.7%
NH4NO3中w(N)=28/80=35%
NH4Cl中w(N)=14/53.5=26.2%
(NH4)2SO4的含氮量大于20%,另一种化肥的含氮量应小于20%,故选B。
四种化肥的含氮量为:(NH4)2SO4中w(N)=28/132=21.2%
CO(NH2)2中w(N)=28/60=46.7%
NH4HCO3中w(N)=14/79=17.7%
NH4NO3中w(N)=28/80=35%
NH4Cl中w(N)=14/53.5=26.2%
(NH4)2SO4的含氮量大于20%,另一种化肥的含氮量应小于20%,故选B。

练习册系列答案
相关题目
 某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:
某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知: