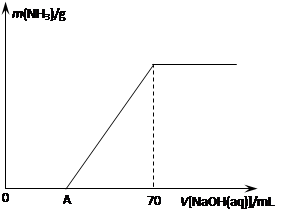题目内容
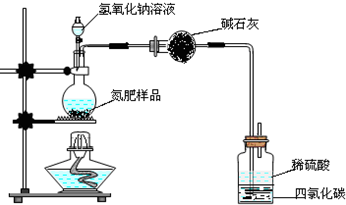 某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:
某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:氢氧化钠少量时:2NH4HSO4+2NaOH=(NH4)2SO4+Na2SO4+2H2O
氢氧化钠过量时:NH4HSO4+2NaOH=Na2SO4+NH3↑+2H2O
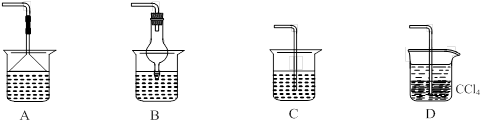
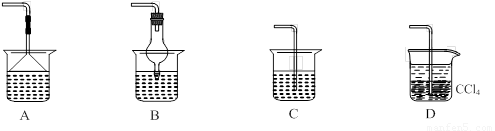
(1)同学们设计的实验装置如图所示,请回答相关问题.
①装置中碱石灰的作用是
吸收氨气中的水蒸气(干燥氨气)
吸收氨气中的水蒸气(干燥氨气)
.②广口瓶内四氯化碳的作用是
防止倒吸
防止倒吸
.③指导老师指出,用该装置进行实验,即使氢氧化钠足量且实验过程中无氨气外泄,测得的样品含氮量仍将偏低,其原因可能是
残留在反应装置中的氨气未被稀硫酸吸收
残留在反应装置中的氨气未被稀硫酸吸收
.(2)同学们改进实验装置后(改进装置图略),进行如下实验.称取不同质量的上述样品分别与40.00mL相同浓度的氢氧化钠溶液相混合,完全溶解后,加热充分反应(此温度下铵盐不分解),并使生成的氨气全部被稀硫酸吸收,测得氨气的质量.部分实验数据如下:
| 氢氧化钠溶液体积/mL | 40.00mL | ||
| 样品质量/g | 7.750 | 15.50 | 23.25 |
| 氨气质量/g | 1.870 | 1.870 | 1.700 |
①样品中的氮元素的质量分数是
19.87
19.87
%.②所用氢氧化钠溶液的物质的量浓度为
3.25
3.25
mol/L.③若样品质量为31.00g,则生成氨气的质量为
1.53
1.53
g.分析:(1)①碱石灰用于干燥氨气;
②氨气极易溶于水,容易发生倒吸现象;
③反应生成的氨气不能够被稀硫酸完全吸收;
(2)①根据实验数据,判断出第一组实验中氢氧化钠过量,所有的铵离子都生成了氨气,根据氮原子守恒列式计算出样品中氮元素的质量分数;
②根据第一组数据计算出硫酸铵和硫酸氢铵的含量,再根据第二组中所有的氢氧化钠都参与了反应,即氢氧化钠不足,计算出氢氧化钠的浓度;
③根据氢氧化钠的物质的量和样品中硫酸氢钠的物质的量,计算出生成的氨气的物质的量及质量.
②氨气极易溶于水,容易发生倒吸现象;
③反应生成的氨气不能够被稀硫酸完全吸收;
(2)①根据实验数据,判断出第一组实验中氢氧化钠过量,所有的铵离子都生成了氨气,根据氮原子守恒列式计算出样品中氮元素的质量分数;
②根据第一组数据计算出硫酸铵和硫酸氢铵的含量,再根据第二组中所有的氢氧化钠都参与了反应,即氢氧化钠不足,计算出氢氧化钠的浓度;
③根据氢氧化钠的物质的量和样品中硫酸氢钠的物质的量,计算出生成的氨气的物质的量及质量.
解答:(1)①生成的氨气中含有水分,用碱石灰吸收氨气中的水分,
故答案为:吸收氨气中的水蒸气;
②氨气极易溶于水,容易发生倒吸,所以广口瓶内四氯化碳用于防止倒吸,
故答案为:防止倒吸;
③用该装置进行实验,即使氢氧化钠足量且实验过程中无氨气外泄,由于装置内的氨气不能完全被稀硫酸吸收,测得的样品含氮量仍将偏低,
故答案为:残留在反应装置中的氨气未被稀硫酸吸收;
(2)①设氮肥硫酸铵的质量分数为X,则硫酸氢铵的质量分数为(1-X),
从实验方案的数据看出,第一个实验和第二个实验中生成的氨气质量相同,说明第一个实验中氢氧化钠是过量的,所有铵离子都生产了氨气,根据氮元素守恒,
×2×17+
×17=1.87
解得:X=0.85,
即氮肥中硫酸铵的质量分数为85%,硫酸氢铵的质量分数为15%,
根据氮原子守恒:氮原子的物质的量就等于氨气的物质的量,
所以样品中氮元素的质量分数为:
×100%=19.87%,
故答案为:19.87%;
②假如第二个实验方案中氢氧化钠是过量的,则生成氨气质量为:
×2×17+
×17=3.28g>1.87g,
这说明第二个实验方案中,氢氧化钠的物质的量不足,氢氧化钠反应完硫酸氢铵中的氢离子后全部生成硫酸铵,剩余的氢氧根离子不足以将全部铵根离子反应溢出,而是只反应了一部分硫酸铵,放出了1.87g氨气;
根据反应方程式:2NH4HSO4+2NaOH=(NH4)2SO4+Na2SO4+2H2O,(NH4)2SO4+2NaOH=Na2SO4+2NH3↑+2H2O,
加入的氢氧化钠的物质的量为:n(NH4HSO4)+n(NH3)=
mol+
mol=0.13mol,
氢氧化钠溶液的浓度为:
=3.25mol/L,
故答案为:3.25mol/L;
③若样品质量为31g,则加入的氢氧化钠物质的量还是0.13mol,
根据反应方程式:2NH4HSO4+2NaOH=(NH4)2SO4+Na2SO4+2H2O,
反应中硫酸氢铵消耗的氢氧化钠的物质的量为:
mol=0.04mol,
剩下的氢氧化钠物质的量为:0.13mol-0.04mol=0.09mol,
根据反应方程式:(NH4)2SO4+2NaOH=Na2SO4+2NH3↑+2H2O,生成的氨气的物质的量为:0.09mol,
所以生成的氨气的质量为:17g/mol×0.09mol=1.53g,
故答案为:1.53.
故答案为:吸收氨气中的水蒸气;
②氨气极易溶于水,容易发生倒吸,所以广口瓶内四氯化碳用于防止倒吸,
故答案为:防止倒吸;
③用该装置进行实验,即使氢氧化钠足量且实验过程中无氨气外泄,由于装置内的氨气不能完全被稀硫酸吸收,测得的样品含氮量仍将偏低,
故答案为:残留在反应装置中的氨气未被稀硫酸吸收;
(2)①设氮肥硫酸铵的质量分数为X,则硫酸氢铵的质量分数为(1-X),
从实验方案的数据看出,第一个实验和第二个实验中生成的氨气质量相同,说明第一个实验中氢氧化钠是过量的,所有铵离子都生产了氨气,根据氮元素守恒,
| 7.75×X |
| 132 |
| 7.75×(1-X) |
| 115 |
解得:X=0.85,
即氮肥中硫酸铵的质量分数为85%,硫酸氢铵的质量分数为15%,
根据氮原子守恒:氮原子的物质的量就等于氨气的物质的量,
所以样品中氮元素的质量分数为:
| ||
| 7.75 |
故答案为:19.87%;
②假如第二个实验方案中氢氧化钠是过量的,则生成氨气质量为:
| 15.00×0.85 |
| 132 |
| 15.00×0.15 |
| 115 |
这说明第二个实验方案中,氢氧化钠的物质的量不足,氢氧化钠反应完硫酸氢铵中的氢离子后全部生成硫酸铵,剩余的氢氧根离子不足以将全部铵根离子反应溢出,而是只反应了一部分硫酸铵,放出了1.87g氨气;
根据反应方程式:2NH4HSO4+2NaOH=(NH4)2SO4+Na2SO4+2H2O,(NH4)2SO4+2NaOH=Na2SO4+2NH3↑+2H2O,
加入的氢氧化钠的物质的量为:n(NH4HSO4)+n(NH3)=
| 15×0.15 |
| 115 |
| 1.87 |
| 17 |
氢氧化钠溶液的浓度为:
| 0.13mol |
| 0.04L |
故答案为:3.25mol/L;
③若样品质量为31g,则加入的氢氧化钠物质的量还是0.13mol,
根据反应方程式:2NH4HSO4+2NaOH=(NH4)2SO4+Na2SO4+2H2O,
反应中硫酸氢铵消耗的氢氧化钠的物质的量为:
| 31×0.15 |
| 115 |
剩下的氢氧化钠物质的量为:0.13mol-0.04mol=0.09mol,
根据反应方程式:(NH4)2SO4+2NaOH=Na2SO4+2NH3↑+2H2O,生成的氨气的物质的量为:0.09mol,
所以生成的氨气的质量为:17g/mol×0.09mol=1.53g,
故答案为:1.53.
点评:本题考查了测定氮肥硫酸铵中氮元素的含量,题目计算量比较大,需要合理分析、应用题中实验数据,得出正确结论,本题充分考查了所学的分析、理解和综合计算能力,本题难度稍大.

练习册系列答案
相关题目
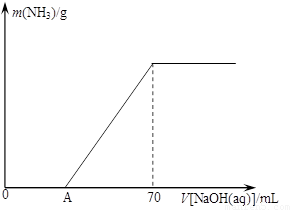
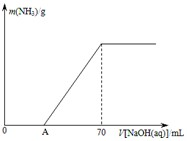 某氮肥NH4HCO3中混有少量(NH4)2CO3,现采用下列方案测定该氮肥中(NH4)2CO3的质量分数:称取5.7g上述样品与2.0mol/L NaOH溶液混合,完全溶解后,低温加热使其充分反应(该温度下铵盐不分解),并使生成的氨气全部被硫酸吸收,测得氨气的质量与所用NaOH溶液体积的关系如图所示:
某氮肥NH4HCO3中混有少量(NH4)2CO3,现采用下列方案测定该氮肥中(NH4)2CO3的质量分数:称取5.7g上述样品与2.0mol/L NaOH溶液混合,完全溶解后,低温加热使其充分反应(该温度下铵盐不分解),并使生成的氨气全部被硫酸吸收,测得氨气的质量与所用NaOH溶液体积的关系如图所示: