题目内容
13.同周期的X、Y、Z三种主族元素,已知它们的最高价氧化物对应的水化物是HXO4、H2YO4、H3ZO4,则下列判断正确的是( )| A. | 含氧酸的酸性:H3ZO4>H2YO4>HXO4 | |
| B. | 非金属性:X>Y>Z | |
| C. | 气态氢化物的稳定性按X、Y、Z顺序由弱到强 | |
| D. | 元素的负化合价的绝对值按X、Y、Z顺序由小到大 |
分析 同周期的X、Y、Z三种主族元素,它们最高价氧化物对应的水化物是HXO4、H2YO4、H3ZO4,则X、Y、Z的最高正化合价分别为+7、+6、+5,则原子序数X>Y>Z.
A.同周期自左而右非金属性增强,非金属性越强,最高价含氧酸的酸性越强;
B.同周期自左而右非金属性增强;
C.非金属性越强,氢化物越稳定;
D.最低负化合价=最高正化合价-8.
解答 解:同周期的X、Y、Z三种主族元素,它们最高价氧化物对应的水化物是HXO4、H2YO4、H3ZO4,则X、Y、Z的最高正化合价分别为+7、+6、+5,则原子序数X>Y>Z.
A.同周期自左而右非金属性增强,故非金属性X>Y>Z,非金属性越强,最高价含氧酸的酸性越强,故含氧酸的酸性H3ZO4<H2YO4<HXO4,故A错误;
B.同周期自左而右非金属性增强,故非金属性X>Y>Z,故B正确;
C.非金属性X>Y>Z,非金属性越强,氢化物越稳定,故氢化物稳定性按X、Y、Z顺序由强到弱,故C错误;
D.X、Y、Z最低负化合价分别为-1、-2、-3,负化合价的绝对值依次增大,故D正确,
故选BD.
点评 本题考查性质与位置关系、元素周期律等,侧重对元素周期律的可知,注意理解掌握同周期元素性质递变规律.

练习册系列答案
相关题目
1.常温下,下列有关离子浓度及pH大小的比较,正确的是( )
| A. | NH4+浓度相同的下列溶液:①(NH4)2Fe(SO4)2 ②(NH4)2CO3 ③(NH4)2SO4溶液浓度由大到小的顺序号:③>②>① | |
| B. | 由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,其离子浓度不可能是:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | 若难溶电解质溶解度:A(OH)m大于B(OH)n,则Ksp也一定是前者大 | |
| D. | pH=4浓度均为0.1mol•L-1的CH3COOH、CH3COONa混合溶液中:c(CH3COO-)-c(CH3COOH)=2×(104-10-10)mol/L |
18.元素性质呈周期性变化的决定因素是( )
| A. | 元素原子半径大小呈周期性变化 | |
| B. | 元素原子最外层电子排布呈周期性变化 | |
| C. | 元素原子量依次递增 | |
| D. | 元素的最高正化合价呈周期性变化同温同压下 |
5.如图所示是298K时N2与H2反应过程中,能量变化的曲线图.下列叙述正确的是( )
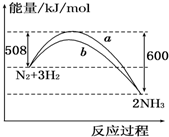

| A. | 该反应的热化学方程式为:N2+3H2?2NH3△H=-92 kJ/mol | |
| B. | a曲线是加入催化剂时的能量变化曲线 | |
| C. | 加入催化剂,该化学反应的反应热改变 | |
| D. | 在温度、体积一定的条件下,通入1 mol N2和3 mol H2反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184>Q2>2Q1 |
2.已知链式块毯C300经过适当处理可得含多个 (不含
(不含 )的链状化合物C300H298,则含
)的链状化合物C300H298,则含 的个数为( )
的个数为( )
 (不含
(不含 )的链状化合物C300H298,则含
)的链状化合物C300H298,则含 的个数为( )
的个数为( )| A. | 70 | B. | 72 | C. | 74 | D. | 76 |
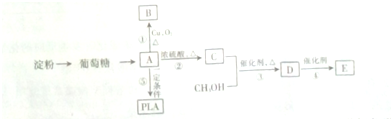
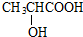 C中所含官能团的名称是羧基、碳碳双键
C中所含官能团的名称是羧基、碳碳双键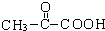 +2H2O反应④的化学方程式为n CH2=CHCOOCH3$\stackrel{催化剂}{→}$
+2H2O反应④的化学方程式为n CH2=CHCOOCH3$\stackrel{催化剂}{→}$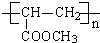
 +(n-1)H2O
+(n-1)H2O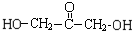 、
、 .
. 研究碳及其化合物的性质对于科研、生产生活具有重要意义.
研究碳及其化合物的性质对于科研、生产生活具有重要意义.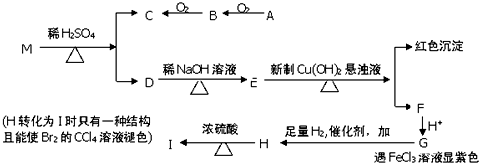
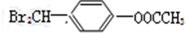

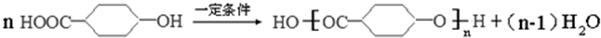
 中任意一种
中任意一种