题目内容
 某化学小组同学向一定量加入少量淀粉的NaHSO3溶液中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝色.
某化学小组同学向一定量加入少量淀粉的NaHSO3溶液中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝色.(1)查阅资料知NaHSO3与过量KIO3反应分为以下两步进行,第一步为IO3-+3HSO3-=3SO42-+3H+,则第二步反应的离子方程式为
(2)通过测定溶液变蓝所用时间来探究浓度和温度对该反应的反应速率的影响.调节反应物浓度和温度进行对比实验,记录如下:
| 编号 | 0.01mol/L NaHSO3溶液/mL | 0.01mol/L KIO3溶液/mL | H2O/mL | 反应温度/℃ | 溶液变蓝的时间t/s |
| ① | 6 | 10 | 4 | 15 | t1 |
| ② | a | 14 | 0 | 15 | t2 |
| ③ | 6 | b | c | 25 | t3 |
(3)改变反应温度,重复实验③,得到溶液变蓝所需时间(t)与温度(T)的关系如图所示(超过50℃后溶液不会再变蓝)A、B、C三点中,反应速率最快的是
(4)将NaHSO3溶液与KIO3溶液混合(预先加入可溶性淀粉为指示剂),用速率检测仪检测出起始阶段反应速率逐渐增大,一段时间后反应速率又逐渐减小.课题组对起始阶段反应速率逐渐增大的原因提出如下假设,请你完成假设二和假设三:
假设一:反应生成的SO42-对反应起催化作用,SO42-浓度越大反应速率越快;
假设二:
假设三:
(5)请你设计实验验证上述假设一,完成下表中内容(反应速率可用测速仪测定)
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
考点:探究影响化学反应速率的因素
专题:实验设计题
分析:(1)NaHSO3溶液中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝色,说明产物中有碘单质生成,由于有第一步反应IO3-+3HSO3-=3SO42-+3H+-+I-,且KIO3溶液过量,所以能产生碘单质的反应为IO3-+5I-+6H+=3I2+3H2O,据此答题;
(2)根据表格,对比①②的数据,可以看出KIO3的浓度不一样,其它条件都一样,所以实验①②是探究浓度对反应速率的影响,而此时a应当等于6,;实验①③是探究温度对反应速率的影响,所以此时两个实验中的浓度都应当相等,所以b=10,c=4,据此答题;
(3)根据图象可知,在B点达到出现蓝色所需要的时间最短,所以反应速率最快,据此答题;
(4)根据影响反应速率的外界因素有浓度、温度、催化剂等,以此加以假设;
(5)通过对比实验进行验证.
(2)根据表格,对比①②的数据,可以看出KIO3的浓度不一样,其它条件都一样,所以实验①②是探究浓度对反应速率的影响,而此时a应当等于6,;实验①③是探究温度对反应速率的影响,所以此时两个实验中的浓度都应当相等,所以b=10,c=4,据此答题;
(3)根据图象可知,在B点达到出现蓝色所需要的时间最短,所以反应速率最快,据此答题;
(4)根据影响反应速率的外界因素有浓度、温度、催化剂等,以此加以假设;
(5)通过对比实验进行验证.
解答:
解:(1)NaHSO3溶液中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝色,说明产物中有碘单质生成,由于有第一步反应IO3-+3HSO3-=3SO42-+3H+-+I-,且KIO3溶液过量,所以能产生碘单质的反应为IO3-+5I-+6H+=3I2+3H2O,
故答案为:IO3-+5I-+6H+=3I2+3H2O;
(2)根据表格,对比①②的数据,可以看出KIO3的浓度不一样,其它条件都一样,所以实验①②是探究浓度对反应速率的影响,而此时a应当等于6,;实验①③是探究温度对反应速率的影响,所以此时两个实验中的浓度都应当相等,所以b=10,c=4,
故答案为:KIO3溶液的浓度;6;10;4;
(3)根据图象可知,在B点达到出现蓝色所需要的时间最短,所以反应速率最快,故答案为:B;
(4)根据影响反应速率的外界因素有浓度、温度、催化剂等加以假设,而在本实验中可能的原因为反应生成的I-对反应起催化作用,I-浓度越大反应速率越快或者反应生成的H+对反应起催化作用,H+浓度越大反应速率越快或者是反应放热,随着反应的进行,温度升高,反应速率加快,
故答案为:反应生成的I-对反应起催化作用,I-浓度越大反应速率越快;反应生成的H+对反应起催化作用,H+浓度越大反应速率越快;
(5)通过对比实验进行验证,具体步骤为在烧杯甲中将一定量的NaHSO3溶液与KIO3溶液混合,用速率检测仪测定其起始时的反应速率v(甲);在烧杯乙中预先加入少量Na2SO4粉末,其他条件与甲完全相同,进行同一反应,用速率检测仪测定其起始阶段相同时间内的反应速率v(乙),若v(甲)=v(乙),则假设一不成立,若v(甲)<v(乙),则假设一成立,
故答案为:在烧杯甲中将一定量的NaHSO3溶液与KIO3溶液混合,用速率检测仪测定其起始时的反应速率v(甲);在烧杯乙中预先加入少量Na2SO4粉末,其他条件与甲完全相同,进行同一反应,用速率检测仪测定其起始阶段相同时间内的反应速率v(乙);若v(甲)=v(乙),则假设一不成立;若v(甲)<v(乙),则假设一成立.
故答案为:IO3-+5I-+6H+=3I2+3H2O;
(2)根据表格,对比①②的数据,可以看出KIO3的浓度不一样,其它条件都一样,所以实验①②是探究浓度对反应速率的影响,而此时a应当等于6,;实验①③是探究温度对反应速率的影响,所以此时两个实验中的浓度都应当相等,所以b=10,c=4,
故答案为:KIO3溶液的浓度;6;10;4;
(3)根据图象可知,在B点达到出现蓝色所需要的时间最短,所以反应速率最快,故答案为:B;
(4)根据影响反应速率的外界因素有浓度、温度、催化剂等加以假设,而在本实验中可能的原因为反应生成的I-对反应起催化作用,I-浓度越大反应速率越快或者反应生成的H+对反应起催化作用,H+浓度越大反应速率越快或者是反应放热,随着反应的进行,温度升高,反应速率加快,
故答案为:反应生成的I-对反应起催化作用,I-浓度越大反应速率越快;反应生成的H+对反应起催化作用,H+浓度越大反应速率越快;
(5)通过对比实验进行验证,具体步骤为在烧杯甲中将一定量的NaHSO3溶液与KIO3溶液混合,用速率检测仪测定其起始时的反应速率v(甲);在烧杯乙中预先加入少量Na2SO4粉末,其他条件与甲完全相同,进行同一反应,用速率检测仪测定其起始阶段相同时间内的反应速率v(乙),若v(甲)=v(乙),则假设一不成立,若v(甲)<v(乙),则假设一成立,
故答案为:在烧杯甲中将一定量的NaHSO3溶液与KIO3溶液混合,用速率检测仪测定其起始时的反应速率v(甲);在烧杯乙中预先加入少量Na2SO4粉末,其他条件与甲完全相同,进行同一反应,用速率检测仪测定其起始阶段相同时间内的反应速率v(乙);若v(甲)=v(乙),则假设一不成立;若v(甲)<v(乙),则假设一成立.
点评:本题主要考查浓度、催化剂对反应速率的影响,对学生的分析能力和逻辑推理能力有一定的要求,中等难度.

练习册系列答案
相关题目
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、16 g甲烷分子中含有共价键的数目为2NA |
| B、常温常压下,30g葡萄糖含有的氧原子数为NA |
| C、0.1mol/L的AlCl3溶液中含有的氯离子数为0.3NA |
| D、25℃时,1L 0.1mol/L的CH3COOH溶液中的H+数为0.1NA |
下列的图示与对应的叙述相符的是( )
A、图 表示KNO3的溶解度曲线,图中a点表示的溶液通过升温可以得到b点 |
B、图 表示某一放热反应,若使用催化剂E1、E2、△H都会发生改变 |
C、图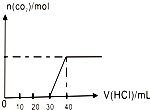 表示向Na2CO3和NaHCO3的混合溶液中滴加稀盐酸时,产生CO2的情况 |
D、图 表示向100mL 0.1mol/L的AlCl3和0.1mol/L的NH4Cl混合溶液中滴加1mol/L的NaOH溶液时n(Al3+)和n(AlO2-)的变化情况 |
下列物质发生变化时,所克服的粒子间相互作用属同种类型的是( )
| A、氯化镁和铁分别熔化为液态 |
| B、氯化钠与氯化氢分别溶解在水中 |
| C、二氧化硅晶体与冰分别受热熔化 |
| D、碘与干冰分别受热变为气体 |




