题目内容
A~F是我们熟悉的单质或化合物,其中A、B均是常见的金属,且B的合金用量最大;E在常温下是黄绿色气体;在适当的条件下,它们之间可以发生如下图所示的转化.

试回答下列问题:
(1)A是 B是 D是 E是 .
(2)检验F中金属阳离子的常用方法是 .
(3)写出F与B发生反应的离子方程式 .

试回答下列问题:
(1)A是
(2)检验F中金属阳离子的常用方法是
(3)写出F与B发生反应的离子方程式
考点:无机物的推断
专题:推断题
分析:B是常见的金属,且B的合金用量最大,B为Fe,由B+盐酸→D+H2可知,D为FeCl2,E在常温下是黄绿色气体,E为Cl2,FeCl2与Cl2反应生成FeCl3,F为FeCl3,FeCl3溶液可以与Fe反应生成FeCl2.A是常见的金属,由A+盐酸→C+H2,C为金属氯化物,C与氢氧化钠反应生成白色沉淀,可以溶于氢氧化钠、盐酸,故该白色沉淀为Al(OH)3,故C为AlCl3,A为Al.
解答:
解:B是常见的金属,且B的合金用量最大,B为Fe,由B+盐酸→D+H2可知,D为FeCl2,E在常温下是黄绿色气体,E为Cl2,FeCl2与Cl2反应生成FeCl3,F为FeCl3,FeCl3溶液可以与Fe反应生成FeCl2.A是常见的金属,由A+盐酸→C+H2,C为金属氯化物,C与氢氧化钠反应生成白色沉淀,可以溶于氢氧化钠、盐酸,故该白色沉淀为Al(OH)3,故C为AlCl3,A为Al,
(1)由上述分析可知,A是Al,B是Fe,D是FeCl2,E是Cl2,故答案为:Al;Fe;FeCl2;Cl2;
(2)检验FeCl3中金属阳离子的常用方法是:加入KSCN溶液,若溶液变红色,则含有Fe3+,故答案为:加入KSCN溶液,若溶液变红色,则含有Fe3+;
(3)F与B发生反应是氯化铁与Fe反应生成氯化亚铁,反应离子方程式为:Fe+2Fe3+=3Fe2+,故答案为:Fe+2Fe3+=3Fe2+.
(1)由上述分析可知,A是Al,B是Fe,D是FeCl2,E是Cl2,故答案为:Al;Fe;FeCl2;Cl2;
(2)检验FeCl3中金属阳离子的常用方法是:加入KSCN溶液,若溶液变红色,则含有Fe3+,故答案为:加入KSCN溶液,若溶液变红色,则含有Fe3+;
(3)F与B发生反应是氯化铁与Fe反应生成氯化亚铁,反应离子方程式为:Fe+2Fe3+=3Fe2+,故答案为:Fe+2Fe3+=3Fe2+.
点评:本题考查无机物推断,涉及Fe、Al等元素单质化合物性质及转化关系,本题中B的合金用量最大,E在常温下是黄绿色气体,白色沉淀可以溶于氢氧化钠与盐酸等均为解题突破口,难度不大.

练习册系列答案
相关题目
下列化学反应方程式或离子方程式书写正确的是( )
| A、乙烯制溴乙烷:CH2CH2+Br2→CH2BrCH2Br | |||
B、乙醇催化氧化:2CH3CH2OH+O2
| |||
C、苯与氢气加成: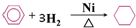 | |||
| D、从海带中提取碘:H2O2+2I-+2H+=I2+2H2O |
据报道,美国科学家制得一种新原子
X,它属于一种新元素116号元素(元素符号暂用X代替),关于它的推测正确的是( )
283 116 |
| A、这种元素一定是金属元素 |
| B、它位于元素周期表中的第六周期 |
| C、这种原子的核外电子数为167 |
| D、这种元素的原子易与氢化合 |
下列有关反应的离子方程式的书写中,不正确的是( )
| A、小苏打与氢氧化钠溶液混合:HCO3-+OH-═CO32-+H2O |
| B、向溴化亚铁溶液中通入少量的Cl2:Cl2+2Br-═2Cl-+Br2 |
| C、向新制氯水中滴加NaOH溶液后,黄绿色褪去:Cl2+2OH-═ClO-+Cl-+H2O |
| D、将鸡蛋壳浸泡在盐酸中:CaCO3+2H+═Ca2++CO2+H2O |
下列实验方案设计中,可行的是( )
| A、加入氢氧化钠溶液后过滤,除去混在镁粉中的铝粉 |
| B、将O2和H2的混合气体通过灼热的氧化铜,以除去其中的H2 |
| C、用溶解、过滤的方法分离KNO3和NaCl固体的混合物 |
| D、用分液漏斗分离汽油和水,水和汽油分别用两个烧杯在下口接 |
 某化学兴趣小组的同学用如图装置研究电化学的问题.
某化学兴趣小组的同学用如图装置研究电化学的问题. 如图所示表示的是电解饱和食盐水的装置,阴极材料、阳极材料都是碳棒,饱和食盐水中含有少量酚酞.
如图所示表示的是电解饱和食盐水的装置,阴极材料、阳极材料都是碳棒,饱和食盐水中含有少量酚酞.