题目内容
用惰性电极电解l 00mL4mol?L-1Cu(NO3)2溶液,一定时间后在阳极收集到标准状况下气体l.12L.停止电解,向电解后的溶液中加入足量的铁粉,充分反应后溶液中的Fe2+浓度为(设溶液的体积不变)( )
分析:阳极反应式为:2H2O-4e-=4H++O2↑,阴极反应式为:Cu2++2e-=Cu,
总的反应式为2Cu(NO3)2+2H2O
2Cu↓+O2↑+4HNO3,
阳极生成气体为氧气,根据n=
计算氧气的物质的量,进而计算电解后溶液中生成的HNO3的物质的量,计算电解后溶液中硝酸铜的物质的量,
硝酸与铁反应生成硝酸亚铁,反应方程式为8HNO3+3Fe=3Fe(NO3)2+2NO↑+4H2O,
硝酸铜与铁反应生成硝酸亚铁,反应方程式为Fe+Cu2+=Fe2++Cu,
根据方程式计算溶液中Fe2+的物质的量,再根据c=
计算反应后Fe2+浓度.
总的反应式为2Cu(NO3)2+2H2O
| ||
阳极生成气体为氧气,根据n=
| V |
| Vm |
硝酸与铁反应生成硝酸亚铁,反应方程式为8HNO3+3Fe=3Fe(NO3)2+2NO↑+4H2O,
硝酸铜与铁反应生成硝酸亚铁,反应方程式为Fe+Cu2+=Fe2++Cu,
根据方程式计算溶液中Fe2+的物质的量,再根据c=
| n |
| V |
解答:解:阳极反应式为:2H2O-4e-=4H++O2↑,阴极反应式为:Cu2++2e-=Cu,
阳极生成气体为氧气,氧气的物质的量为
=0.05mol,则:
总的反应式为:2Cu(NO3)2+2H2O
2Cu↓+O2↑+4HNO3,
2 1 4
0.1mol 0.05mol 0.2mol
故电解后溶液中生成的HNO3的物质的量为0.2mol,
电解后溶液中硝酸铜的物质的量为0.1L×4mol?L-1-0.1mol=0.3mol,
硝酸与铁反应生成硝酸亚铁,反应方程式为8HNO3+3Fe=3Fe(NO3)2+2NO↑+4H2O,故0.2molHNO3生成Fe(NO3)2的物质的量为:0.2mol×
=0.075mol,
硝酸铜与铁反应生成硝酸亚铁,反应方程式为Fe+Cu2+=Fe2++Cu,故0.3mol硝酸铜生成Fe(NO3)2的物质的量为0.3mol,
反应后溶液中Fe2+的物质的量为0.3mol+0.075mol=0.375mol,反应后溶液中Fe2+浓度为
=3.75mol/L,
故选D.
阳极生成气体为氧气,氧气的物质的量为
| 1.12L |
| 22.4L/mol |
总的反应式为:2Cu(NO3)2+2H2O
| ||
2 1 4
0.1mol 0.05mol 0.2mol
故电解后溶液中生成的HNO3的物质的量为0.2mol,
电解后溶液中硝酸铜的物质的量为0.1L×4mol?L-1-0.1mol=0.3mol,
硝酸与铁反应生成硝酸亚铁,反应方程式为8HNO3+3Fe=3Fe(NO3)2+2NO↑+4H2O,故0.2molHNO3生成Fe(NO3)2的物质的量为:0.2mol×
| 3 |
| 8 |
硝酸铜与铁反应生成硝酸亚铁,反应方程式为Fe+Cu2+=Fe2++Cu,故0.3mol硝酸铜生成Fe(NO3)2的物质的量为0.3mol,
反应后溶液中Fe2+的物质的量为0.3mol+0.075mol=0.375mol,反应后溶液中Fe2+浓度为
| 0.375mol |
| 0.1L |
故选D.
点评:本题考查电解原理、混合物的有关计算等,难度中等,清楚反应的过程是解题的关键,本题利用过程法解答,思路清晰,计算稍微麻烦,可以利用守恒思想进行解答.

练习册系列答案
相关题目


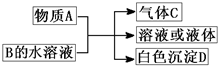 (2011?崇文区模拟)A、B、C、D均为中学化学常见物质,它们之间的反应关系如图所示.
(2011?崇文区模拟)A、B、C、D均为中学化学常见物质,它们之间的反应关系如图所示.