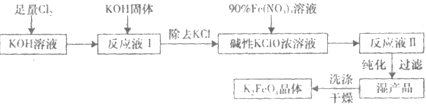
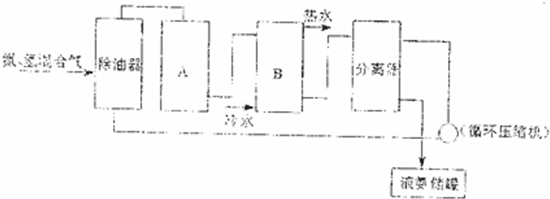
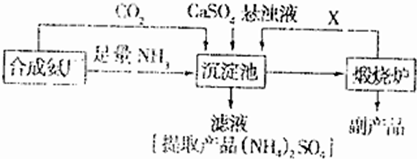
题目内容
(化学-化学与技术)

 金属铝的生产是以Al2O3为原料,在熔融状态下进行电解:
金属铝的生产是以Al2O3为原料,在熔融状态下进行电解:
请回答下列问题: (1)冰品石(Na3AlF6)的作用是 。
(1)冰品石(Na3AlF6)的作用是 。 (2)电解生成的金属铝是在熔融液的 (填“上层”或“下层”)。
(2)电解生成的金属铝是在熔融液的 (填“上层”或“下层”)。 (3)阴极和阳极均由 材料做成;电解时所消耗的电极是 (填“阳极”或“阴极”)。
(3)阴极和阳极均由 材料做成;电解时所消耗的电极是 (填“阳极”或“阴极”)。 (4)铝是高耗能产品,废旧铝材的回收利用十分重要。在工业上,最能体现节能减排思想的是将回收铝做成 (填代号)。
(4)铝是高耗能产品,废旧铝材的回收利用十分重要。在工业上,最能体现节能减排思想的是将回收铝做成 (填代号)。 a.冰品石 b.氧化铝 c.铝锭 d.硫酸铝
a.冰品石 b.氧化铝 c.铝锭 d.硫酸铝
(1)降低Al2O3的熔化温度 (2)下层 (3)碳棒(或石墨) 阳极 (4)c
(2)下层 (3)碳棒(或石墨) 阳极 (4)c
解析

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
【化学--选修化学与技术】
下图是某工厂对海水资源进行综合利用的示意图.
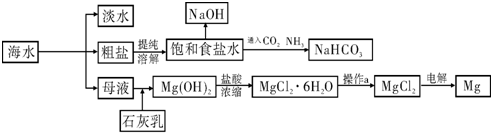
请回答下列问题:
(1)请列举一种海水淡化的方法 .;
(2)工业上常用离子交换膜电解槽生产NaOH,电解过程中大量通过离子交换膜的离子是 ,NaOH在电解槽的 室生成,由饱和食盐水制取NaOH的化学方程式为 ;
(3)侯氏制碱法中首先向饱和食盐水中通入CO2和NH3制得NaHCO3,先通入
(填化学式),理由是 .再由NaHCO3制得纯碱,化学方程式为 .
(4)镁是一种用途很广泛的金属材料,目前世界上60%的镁从海水中提取.已知有关物质的熔沸点数据如下:
结合表中数据和实际生产情况说明,工业上生产镁采用电解MgCl2而不是电解MgO的理由 .
下图是某工厂对海水资源进行综合利用的示意图.

请回答下列问题:
(1)请列举一种海水淡化的方法
(2)工业上常用离子交换膜电解槽生产NaOH,电解过程中大量通过离子交换膜的离子是
(3)侯氏制碱法中首先向饱和食盐水中通入CO2和NH3制得NaHCO3,先通入
(填化学式),理由是
(4)镁是一种用途很广泛的金属材料,目前世界上60%的镁从海水中提取.已知有关物质的熔沸点数据如下:
| MgO | MgCl2 | |
| 熔点/℃ | 2852 | 714 |
| 沸点/℃ | 3600 | 1412 |