题目内容
【题目】如图为某原电池装置:

(1)若A为铜,B为铁,电解质溶液为Fe2(SO4)3溶液,则铁片为______极(填“正”或“负”),A极电极反应式为_______,是_______(填“氧化反应”或“还原反应”)。
(2)若A为PbO2,B为Pb,电解质溶液为稀硫酸,放电时的方程式为:PbO2+Pb+2H2SO4=2PbSO4+2H2O,则B极的电极反应式为_________,H+向__________(填“正”或“负”)极移动。
(3)若A、B均为Pt电极,电解质溶液为稀硫酸,则向A极通入H2, B极通入O2,B极的反应为:O2+4e-+4H+=2H2O,则A极的电极反应式为_____________。
【答案】负 Fe3++e-=Fe2+ 还原反应 Pb-2e-+SO42-=PbSO4 正 H2-2e-=2H+(或2H2-4e-=4H+)
【解析】
(1)若A为铜,B为铁,电解质溶液为Fe2(SO4)3溶液,Fe易失电子作负极、Cu作正极,正极上铁离子得电子生成亚铁离子,电极反应式为Fe3++e-=Fe2+,铁元素化合价降低,发生还原反应;
(2)若A为PbO2,B为Pb,电解质溶液为稀硫酸,根据放电时的方程式PbO2+Pb+2H2SO4=2PbSO4+2H2O,Pb失电子发生氧化反应,Pb为负极、PbO2为正极;则负极B的电极反应式为Pb-2e-+SO42-=PbSO4,原电池中阳离子移向正极,所以H+向正极移动;
(3) B极的反应为:O2+4e-+4H+=2H2O,则B发生还原反应,B为正极,A为负极,负极氢气失电子生成氢离子,负极反应式是H2-2e-=2H+。

【题目】已知:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,如图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好。下表中由实验现象得出的结论完全正确的是( )
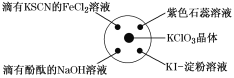
选项 | 实验现象 | 结论 |
A | 滴有KSCN的FeCl2溶液变红 | Cl2具有还原性 |
B | 滴有酚酞的NaOH溶液褪色 | Cl2具有酸性 |
C | 紫色石蕊溶液先变红后褪色 | Cl2具有漂白性 |
D | KI淀粉溶液变成蓝色 | Cl2具有氧化性 |
A.AB.BC.CD.D