题目内容
【题目】某溶液X含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的几种,已知该溶液中各离子物质的量浓度均为
中的几种,已知该溶液中各离子物质的量浓度均为![]() 不考虑水的电离及离子的水解
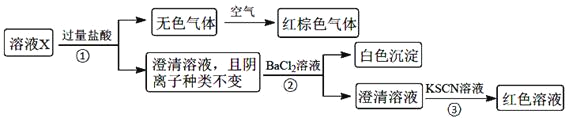
不考虑水的电离及离子的水解![]() 。为确定该溶液中含有的离子,现进行了如下的操作:
。为确定该溶液中含有的离子,现进行了如下的操作:
下列说法正确的是![]()
A.无色气体可能是NO和![]() 的混合物
的混合物
B.由步骤![]() 可知,原溶液肯定存在
可知,原溶液肯定存在![]()
C.溶液X中所含离子种类共有4种
D.另取100mL原溶液X,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,理论上得到的固体质量为![]()
【答案】D
【解析】
溶液X加入过量盐酸生成无色气体,该气体与空气变红棕色,则可说明生成NO,X中一定含有NO3-和还原性离子,应为Fe2+,则溶液中一定不存在CO32-、OH-、SiO32-,都与Fe2+反应生成沉淀,加入盐酸后阴离子种类不变,则说明X中含有Cl-,加入氯化钡生成白色沉淀,则一定含有SO42-,加入KSCN溶液呈红色,因Fe2+被氧化成Fe3+,则不能证明X中含有Fe3+,结合各离子物质的量浓度均为![]() 解答该题。
解答该题。
溶液X加入过量盐酸生成无色气体,该气体与空气变红棕色,则可说明生成NO,X中一定含有![]() 和还原性离子,应为
和还原性离子,应为![]() ,则溶液中一定不存在
,则溶液中一定不存在![]() 、
、![]() 、
、![]() ,都与
,都与![]() 反应生成沉淀,加入盐酸后阴离子种类不变,则说明X中含有
反应生成沉淀,加入盐酸后阴离子种类不变,则说明X中含有![]() ,加入氯化钡生成白色沉淀,则一定含有
,加入氯化钡生成白色沉淀,则一定含有![]() ,加入KSCN溶液呈红色,因
,加入KSCN溶液呈红色,因![]() 被氧化成
被氧化成![]() ,则不能证明X中含有
,则不能证明X中含有![]() ,则溶液中一定存在的离子有
,则溶液中一定存在的离子有![]() 、
、![]() 、
、![]() 、
、![]() ,溶液中各离子物质的量浓度均为
,溶液中各离子物质的量浓度均为![]() ,则还应含有
,则还应含有![]() 、
、![]() 、
、![]() 、
、![]() 中的离子,结合电荷守恒可知,应含有
中的离子,结合电荷守恒可知,应含有![]() ,则:
,则:
A.无色气体只能为NO,故A错误;
B.由以上分析可知不含![]() ,故B错误;
,故B错误;
C.溶液X中所含离子有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,共5种,故C错误;
,共5种,故C错误;
D.另取100mL原溶液X,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,可得到0.01molFe2O3和0.02molMgO,二者质量共为![]() ,故D正确;
,故D正确;
故选D。

 阅读快车系列答案
阅读快车系列答案【题目】一定温度时,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应:2SO2(g)+O2(g)![]() 2SO3(g) H=196kJ·moL1,一段时间后达平衡,反应过程中测定的部分数据见下表:
2SO3(g) H=196kJ·moL1,一段时间后达平衡,反应过程中测定的部分数据见下表:
反应时间/min | n(SO2)/mol | n(O2)/mol |
0 | 2 | 1 |
5 | 1.2 | |
10 | 0.4 | |
15 | 0.8 |
下列说法不正确的是
A. 反应在前5min的平均速率为v (SO2)=0.08mol·L1·min1
B. 保持温度不变,向平衡后的容器中再充入0.2molSO2和0.2mol SO3时,v (正)>v (逆)
C. 保持其他条件不变,若起始时向容器中充入2molSO3,达平衡时吸收78.4kJ的热量
D. 相同温度下,起始时向容器中充入1.5mol SO3,达平衡时SO3的转化率为40%