题目内容
【题目】乙苯(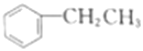 )是重要的化工原料,工业上利用乙苯可以制备苯乙烯和β-氯苯乙烷:
)是重要的化工原料,工业上利用乙苯可以制备苯乙烯和β-氯苯乙烷:
乙苯脱氢制苯乙烯:
![]() △H1=akJ/mol
△H1=akJ/mol
乙苯氯化制β-氯苯乙烷:
![]() △H2=bkJ/mol
△H2=bkJ/mol
回答下列问题:
(1)利用下表提供的数据计算a=_____。乙苯脱氢制苯乙烯的反应在_____(填“高温”或“低温”)有利于其自发进行。
化学键 | C-H | C-C | H-H | C=C |
键能/kJ/mol | 412 | 348 | 436 | 612 |
(2)已知
![]() +HCl(g)
+HCl(g)![]()
![]() △H=-54kJ/mol
△H=-54kJ/mol
H2(g)+Cl2(g)=2HCl(g) △H=-185kJ/mol 则b=______________。
(3)T℃,将nmol乙苯加入到体积为V L的恒容容器中,发生脱氢反应,容器内压强随时间变化如下表所示:
时间/min | 0 | 10 | 20 | 30 | 40 |
压强/×100 kPa | 1.0 | 1.2 | 1.3 | 1.4 | 1.4 |
平衡时容器内气体的总物质的量为______,乙苯的转化率为______%。
(4)工业由乙苯脱氢制苯乙烯实际上是在恒压密闭容器中进行的。将m mol乙苯通入某恒压密闭容器中(反应过程中维持压强为p),乙苯的平衡转化率随温度变化如右图所示:
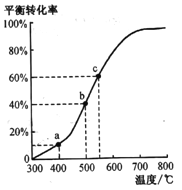
①在a点所示的条件下,向该容器中通入25L水蒸气,则乙苯的转化率______(填“变大”“变小”或不变),生成苯乙烯的速率________(填“变大”“变小”或不变)。
②b点气体总体积______(填“<”“>”或“=”)c 点气体总体积。
③c点平衡常数Kp=_______(用平衡分压代替平衡浓度,平衡分压=物质的量分数×总压)。
【答案】 +124 高温 -115 1.4nmol 40 变大 变小 < ![]()
【解析】(1)根据方程式,变化的化学键有断开了2个C-H键,C-C变成了C=C,形成了1个H-H,根据下表数据,△H=反应物总键能-生成物总键能=2×412+348-436-612=+124 kJ/mol;乙苯脱氢制苯乙烯的反应中△H>0,△S>0,根据△G=△H-T△S<0反应自发进行,因此该反应在高温下才能自发进行,故答案为:+124;高温;
(2)已知①![]() +HCl(g)
+HCl(g)![]()
![]() △H=-54kJ/mol,②H2(g)+Cl2(g)=2HCl(g)△H=-185kJ/mol,③
△H=-54kJ/mol,②H2(g)+Cl2(g)=2HCl(g)△H=-185kJ/mol,③![]() △H1=+124kJ/mol,根据盖斯定律,将①+②+③得
△H1=+124kJ/mol,根据盖斯定律,将①+②+③得![]() △H2=(-54kJ/mol)+(-185kJ/mol)+(+124kJ/mol)=-115kJ/mol,故答案为:-115;
△H2=(-54kJ/mol)+(-185kJ/mol)+(+124kJ/mol)=-115kJ/mol,故答案为:-115;
(3)设反应的乙苯的物质的量为x,
![]()
起始(mol) n 0 0
反应(mol) x x x
平衡(mol) n-x x x
根据压强之比=物质的量之比, ![]() =1.4,解得x=0.4n,平衡时容器内气体的总物质的量为1.4nmol,乙苯的转化率为
=1.4,解得x=0.4n,平衡时容器内气体的总物质的量为1.4nmol,乙苯的转化率为![]() ×100%=40%,故答案为:1.4nmol;40;
×100%=40%,故答案为:1.4nmol;40;
(4)①在a点所示的条件下,向该容器中通入25L水蒸气,容器的体积增大,相当于减小压强,![]() ,平衡正向移动,乙苯的转化率变大;减小压强,生成苯乙烯的速率变小,故答案为:变大; 变小;
,平衡正向移动,乙苯的转化率变大;减小压强,生成苯乙烯的速率变小,故答案为:变大; 变小;
②根据![]() ,乙苯的平衡转化率越大,反应后气体的总体积越大,b点气体总体积<c点气体总体积,故答案为:<;
,乙苯的平衡转化率越大,反应后气体的总体积越大,b点气体总体积<c点气体总体积,故答案为:<;
③ ![]()
起始(mol) m 0 0
反应(mol) 0.6m 0.6m 0.6m
平衡(mol) 0.4m 0.6m 0.6m
平衡分压 ![]() p
p ![]() p
p ![]() p
p
c点平衡常数Kp=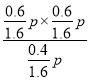 =
=![]() p,故答案为:
p,故答案为: ![]() p。
p。

 阅读快车系列答案
阅读快车系列答案