题目内容
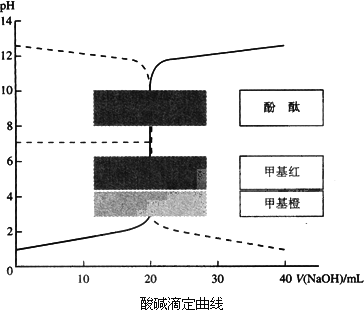
Ⅰ:(1)甲同学为了证明氢氧化钠溶液与稀盐酸能够发生反应,设计并完成了如下图所示实验.则X溶液是

(2)乙同学也设计完成了另一个实验,证明氢氧化钠溶液与盐酸能够发生反应.在盛有25.00mL稀盐酸的锥形瓶中,用胶头滴管慢慢滴入氢氧化钠溶液,不断振荡,每加一滴溶液测定并记录一次溶液的pH值,直至氢氧化钠溶液过量.
①写出测定溶液pH值的操作方法:
②下图中哪个图象符合该同学的记录

(3)你认为甲、乙两位同学的实验中,
Ⅱ:丙学生用0.100mol?L-1氢氧化钠溶液滴定未知浓度的盐酸.他用移液管准确移取.
25.00mL未知浓度的盐酸置于一洁净的锥形瓶中,然后用0.100mol?L-1的氢氧化钠溶液(指示剂为酚酞)进行滴定.滴定结果如下:
滴定次数 |
盐酸的体积/mL |
NaOH溶液的体积/mL | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 2.00 | 20.20 |
| 2 | 25.00 | 1.02 | 21.03 |
| 3 | 25.00 | 0.20 | 20.20 |
(2)如果滴定的终点没有控制好,即NaOH溶液过量,溶液显深红色,如何补救?请设计实验方案.
(2)①沉淀PH的操作方法;②反应开始前,是盐酸溶液,pH小于7,之后PH逐渐增大;
(3)乙同学更加充分证明氢氧化钠和盐酸发生了反应,甲同学的实验有可能是酚酞遇氢氧化钠溶液直接变成红色,乙同学的实验,随着滴加氢氧化钠溶液,溶液的pH由小于7逐渐增大到7,这充分证明溶液中的盐酸因反应而消耗;
Ⅱ、(1)算出三次滴定消耗的氢氧化钠的体积,误差大的舍弃掉,再求出氢氧化钠溶液的体积的平均值,最后计算出盐酸的浓度;
(2)用上述未知浓度的盐酸进行反滴,记录所需盐酸的体积.
(2)①测定溶液PH的方法是:用干净的玻璃棒蘸取待测液点在pH试纸中间,将试纸的颜色与标准比色卡对照,读出溶液的pH,
故答案为:用干净的玻璃棒蘸取待测液点在pH试纸中间,将试纸的颜色与标准比色卡对照,读出溶液的pH;
②反应前溶液是盐酸,pH小于7,随着氢氧化钠的滴入,溶液pH逐渐增大,故D正确,故选D;
(3)乙同学的实验能够充分证明氢氧化钠和盐酸发生了反应,因为甲同学的实验有可能是酚酞遇氢氧化钠溶液直接变成红色,乙同学的实验,随着滴加氢氧化钠溶液,溶液的pH由小于7逐渐增大到7,这充分证明溶液中的盐酸因反应而消耗了,
故答案为:乙同学;甲同学的实验有可能是酚酞遇氢氧化钠溶液直接变成红色,乙同学的实验,随着滴加氢氧化钠溶液,溶液的pH由小于7逐渐增大到7,这充分证明溶液中的盐酸因反应而消耗了;
Ⅱ:(1)三次消耗氢氧化钠溶液的体积为:18.20mL、20.01mL、20.00mL,第一次数据误差过大,舍弃掉,消耗氢氧化钠溶液体积的平均值约为20.00mL,盐酸的浓度为:c(HCl)=
| 0.100×0.020 |
| 0.025 |
故答案为:0.080;
(2)如果氢氧化钠滴入过量,可以用待测液反滴,记下消耗的盐酸的体积,故答案为:用上述未知浓度的盐酸进行反滴,记录所需盐酸的体积.

【研究课题】探究草酸晶体受热分解的产物
【查阅资料】该小组同学通过网络查询,获得草酸及草酸晶体的一些相关知识:
名称 | 分子式 | 颜色、状态 | 溶解性 | 熔点/℃ | 密度/g·cm-3 |
草酸 | H2C2O4 | — | 易溶于水 | 189.5 | 1.900 |
草酸晶体 | H2C2O4·2H2O | 无色晶体 | — | 101.5 | 1.650 |
备注:草酸晶体失去结晶水后,175 ℃以上开始分解。
【提出猜想】(1)__________________________________;
(2)分解产物中的气体可能是CO、CO2或它们的混合物。
【设计方案】(1)请设计完成“猜想(1)”的实验方案〔用简要的实验装置图表示,要体现所使用仪器(加热和夹持仪器不必画出)和试剂〕。

(2)化学学习小组的同学继续利用下图所示装置进行“猜想(2)”的实验探究。已知:A、C、F中盛装澄清石灰水,B中盛装浓NaOH溶液,D中装有碱石灰,E中装有CuO。

①证明分解产物中有CO2的现象是______________________;证明分解产物中有CO的现象是______________________。
②若未连接装置G,要达到同样的目的,可采取的措施是______________________。
【交流讨论】小李同学继续查阅相关资料发现:草酸是二元弱酸,酸性比碳酸强,在受热分解过程中有少量升华;草酸钙和草酸氢钙均为白色不溶物。小李通过进一步研究,对实验中CO2的检验提出质疑。试根据相关信息,指出原设计中存在的问题,并提出实验的改进措施。_____________________________________________________________________。
【研究课题】 探究草酸晶体受热分解的产物
【查阅资料】 该小组同学通过网络查询,获得草酸及草酸晶体的一些相关知识:
名称 | 分子式 | 颜色、状态 | 溶解性 | 熔点/℃ | 密度/g·cm-3 |
草酸 | H2C2O4 | — | 易溶于水 | 189.5 | 1.900 |
| H2C2O4·2H2O | 无色晶体 | — | 101.5 | 1.650 |
备注:草酸晶体失去结晶水后,175 ℃以上开始分解。
【提出猜想】(1)_____________________________________________________。
(2)分解产物中的气体可能是CO、CO2或它们的混合物。
【设计方案】 (1)请设计完成“猜想(1)”的实验方案〔用简要的实验装置图表示,要体现所使用仪器(加热和夹持仪器不必画出)和试剂〕。

(2)化学学习小组的同学继续利用下图所示装置进行“猜想(2)”的实验探究。已知:A、C、F中盛装澄清石灰水,B中盛装浓NaOH溶液,D中装有碱石灰,E中装有CuO。

①证明分解产物中有CO2的现象是___________________________;证明分解产物中有CO的现象是_________________________________________________________________。
②若未连接装置G,要达到同样的目的,可采取的措施是______________________________
_____________________________________________________________________。
【交流讨论】 小李同学继续查阅相关资料发现:草酸是二元弱酸,酸性比碳酸强,在受热分解过程中有少量升华;草酸钙和草酸氢钙均为白色不溶物。小李通过进一步研究,对实验中CO2的检验提出质疑。试根据相关信息,指出原设计中存在的问题,并提出实验的改进措施。
_____________________________________________________________________
_____________________________________________________________________。
下面是某化学学习小组的同学进行研究性学习的过程,请你参与并协助他们完成相关学习任务。
【研究课题】探究草酸晶体受热分解的产物
【查阅资料】该小组同学通过网络查询,获得草酸及草酸晶体的一些相关知识:
| 名称 | 分子式 | 颜色、状态 | 溶解性 | 熔点(℃) |
| 草酸 | H2C2O4 | ― | 易溶于水 | 189.5 |
| 草酸晶体 | H2C2O4?2H2O | 无色晶体 | ― | 101.5 |
(备注:草酸晶体失去结晶水后,175℃以上开始分解)
【提出猜想】(1) ;
(2)分解产物中气体可能是CO、CO2或它们的混合物。
【设计方案】(1)请设计验证“猜想(1)”的实验方案。其中所使用的试剂是 ;
(2)化学学习小组的同学继续利用下图所示装置进行“猜想(2)”的实验探究。已知:A、C、F中盛装澄清石灰水,B中盛装浓NaOH溶液,D中装有碱石灰,E中装有CuO。

①证明分解产物中有CO2的现象是 ;
证明分解产物中有CO的现象是 ;
②装置B的作用是 ;
③若未连接装置G,要达到同样的目的,可采取的措施是 。
【交流讨论】小李同学继续查阅相关资料发现:草酸为二元弱酸,酸性比碳酸强,在受热分解过程中有少量升华;草酸钙和草酸氢钙均为白色不溶物。小李进―步研究后,对实验中CO2的检验方案提出质疑。试根据相关信息,指出原设计中存在的问题,并提出实验的改进措施。 。
【实验结论】写出草酸晶体受热分解的化学方程式 。
 Ⅰ.某学校研究性学习小组开展“不同条件对化学反应速率影响的探究”课题,选用4mL 0.01mol?L-1KMnO4溶液与2mL 0.1mol?L-1 H2C2O4溶液进行实验,改变条件如下:
Ⅰ.某学校研究性学习小组开展“不同条件对化学反应速率影响的探究”课题,选用4mL 0.01mol?L-1KMnO4溶液与2mL 0.1mol?L-1 H2C2O4溶液进行实验,改变条件如下: