题目内容
现有质量分数为15%的食盐溶液20 g,质量分数为40%的食盐溶液15 g,另有足够多的食盐固体和水,要配制质量分数为20%的食盐溶液30 g。
(1)试选择多种可能的配制方法(至少四种)。
(2)若要求尽可能多地使用现有的食盐水,应如何配制?
见解析
解析

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
有关化学用语表达正确的是
A.聚丙烯的结构简式: |
B.C1 的结构示意图: 的结构示意图: |
C. 互为同位素 互为同位素 |
D.过氧化氢电子式: |
设NA代表阿伏加德罗常数的数值,下列说法中正确的是
| A.1.8 g重水(D2O)中含有的质子数和电子数均为1.0 NA |
| B.含4 mol Si-O键的二氧化硅晶体中,氧原子数为2NA |
| C.标准状况下,22.4 L NO 和22.4 L O2 混合后所得气体中分子总数为1.5 NA |
| D.将11.2 L Cl2 通入足量的石灰乳中制备漂白粉,转移的电子数为0.5 NA |
下列化学用语中表述正确的是( )
A.甲醛的电子式: |
| B.二氧化硅的分子式SiO2 |
C.丙烷的分子球棍模型示意图: |
D. 离子结构示意图: 离子结构示意图: |
设NA代表阿伏加德罗常数,下列说法不正确的是
| A.4.6克钠与水反应时失去的电子数目为0.2NA |
| B.常温常压下2克氢气所含原子数目为NA |
| C.在标准状况下,22.4LNH3所含的分子数目为NA |
| D.1 L0.5mol?L-1Na2SO4溶液中所含有的Na+离子数目为NA |
下列化学用语表示正确的是 ( )。
A.Cl-的结构示意图: |
B.甲烷分子的球棍模型: |
C.氢氧化钠的电子式: |
| D.次氯酸的结构式:H—O—Cl |
某工厂废水中含5.00×10-3 mol·L-1的Cr2O72-,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5 Fe1.5FeO4的流程图示意如下: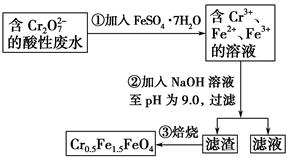
下列有关判断错误的是( )。
| A.操作①中反应的离子方程式为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O |
| B.操作②所得的滤渣成分主要为Fe(OH)3、Fe(OH)2、Cr(OH)3 |
| C.磁性材料Cr0.5Fe1.5FeO4中,显+3价铁与显+2价铁的质量之比为2∶3 |
| D.若废水中杂质不与绿矾反应,将该1 L废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4,理论上需加入绿矾13.9 g |
