题目内容
纳米是长度单位,1纳米等于1×10-9米,物质的颗粒达到纳米级时,具有特殊的性质。例如
将单质铜制成“纳米铜”时,具有非常强的化学活性,在空气中可以燃烧。下列对“纳米铜” 的有关叙述正确的是( )
| A.常温下“纳米铜”比铜片的还原性强,反应时反应速率快 |
| B.“纳米铜”颗粒更细小,化学反应时接触面大,所以反应速率快 |
| C.“纳米铜”与铜是同素异形体 |
| D.常温下“纳米铜”比铜片更易得电子,反应时反应速率快 |
B
解析试题分析:A、“纳米铜”与铜片都属于铜元素,还原性相同,但前者反应速率快,错误;B、“纳米铜”颗粒更细小,增大了反应的接触面积,所以反应速率快,正确;C、“纳米铜”与铜是同种物质,错误;D、金属不会得到电子,错误,答案选B。
考点:考查纳米级颗粒与普通颗粒的异同

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
升高温度时,化学反应速率加快,主要原因是( )
| A.分子运动速率加快,使该反应物分子的碰撞机会增多 |
| B.反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多 |
| C.该化学反应的过程是吸热的 |
| D.该化学反应的过程是放热的 |
在2L恒容密闭容器中充入2 mol X和1mol Y发生反应:2X(g)+Y(g) 3Z(g) △H<0,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是
3Z(g) △H<0,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是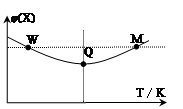
| A.升高温度,平衡常数增大 |
| B.W点X的正反应速率等于M点X的正反应速率 |
| C.Q点时,Y的转化率最大 |
| D.平衡时充入Z,达到新平衡时Z的体积分数比原平衡时大 |
下列说法正确的是
| A.一定温度下,反应2NaCl(s)=2Na(s)+Cl2(g)的△H<0,△S>0 |
| B.温度一定时,向水中滴加少量酸或碱形成稀溶液,水的离子积常数Kw不变 |
| C.常温下,将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
| D.由于Ksp(BaSO4)<Ksp(BaCO3),因此不可能使BaSO4沉淀转化为BaCO3沉淀 |
CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示,下列结论不正确的是( )
| A.反应开始2 min内平均反应速率最大 |
| B.反应速率先增大后又减小 |
| C.反应开始4 min内温度对反应速率的影响比浓度大 |
| D.反应在第2 min到第4 min间生成CO2的平均反应速率为v(CO2)=0.1 mol·min-1 |
N2O5是一种新型硝化剂,其性质和制备受到人们的关注。一定温度下,在2 L固定容积的密闭容器中发生反应:2N2O5(g) 4NO2(g)+O2(g) ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列说法中不正确的是( )
4NO2(g)+O2(g) ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列说法中不正确的是( )
| A.曲线a表示NO2的物质的量随时间的变化 |
| B.10 s时,v(正)>v(逆) |
| C.20 s时反应达到平衡 |
| D.0~20 s内平均反应速率v(O2)=0.05 mol·L-1·s-1 |
反应C(s)+H2O(g) CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
| A.增加C的量 |
| B.将容器的体积缩小一半 |
| C.保持体积不变,充入H2O(g)使体系压强增大 |
| D.保持压强不变,充入N2使容器体积变大 |
 C达到平衡后,B的转化率与压强、温度的关系如下图,下列说法正确的是( )
C达到平衡后,B的转化率与压强、温度的关系如下图,下列说法正确的是( )
 3C(g)+D(s) ΔH1>0,②xM(g)+N(g)
3C(g)+D(s) ΔH1>0,②xM(g)+N(g) 3Q(g) ΔH2。反应①中各物质与反应②中各物质均不发生反应。在某容器里只进行反应②,M的转化率与温度、压强的关系如图所示。
3Q(g) ΔH2。反应①中各物质与反应②中各物质均不发生反应。在某容器里只进行反应②,M的转化率与温度、压强的关系如图所示。