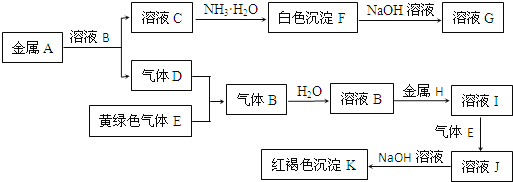
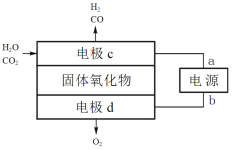
题目内容
【题目】氧化钡广泛用于玻璃、陶瓷工业,是制取过氧化钡和钡盐的原料。一种利用钡泥[含BaCO3、BaSO3、Ba(FeO2)2等]制取氧化钡的绿色工艺流程如下:
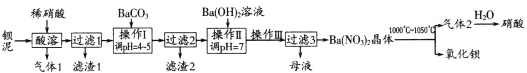
回答下列问题:
(1)酸溶时,Ba(FeO2)2与稀硝酸反应的化学方程式为_____________________。
(2)产生滤渣1的反应离子方程式是____________________________________________。
(3)操作Ⅰ调pH=4~5的目的是_________________________________________________。
(4)过滤3所得母液应返回______________工序循环使用。
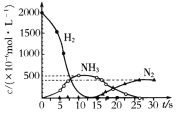
(5)Ba(NO3)2可用于汽车尾气中还原性气体的催化转化。科技工作者用H2模拟尾气中的还原性气体,研究Ba(NO3)2的催化还原过程。该过程分两步进行,如图表示该过程相关物质浓度随时间的变化关系。第二步反应消耗的NH3与NO3-的物质的量之比是_________。
(6)“气体2”为混合气体。标准状况下a L“气体2”溶于水得到bL溶液,则所得溶液的物质的量浓度为_________________
【答案】Ba(FeO2)2+8HNO3= Ba(NO3)2+2Fe(NO3)3+4H2O 3BaSO3+2H++2NO3-= 3BaSO4+2NO↑+H2O 将Fe3+转化成Fe(OH)3沉底而除去 操作Ⅱ 5:3 ![]()
【解析】
钡泥加入稀硝酸时,碳酸钡生成硝酸钡和二氧化碳和水,亚硫酸钡生成硫酸钡、NO和水,Ba(FeO2)2生成硝酸钡、硝酸铁和水,则气体1 为二氧化碳,滤渣1为硫酸钡;加入碳酸钡调节pH,可使铁离子生成氢氧化铁沉淀,则滤渣2为氢氧化铁;加入氢氧化钡中和溶液中过量的硝酸,生成硝酸钡溶液,则母液为硝酸钡;加热硝酸钡晶体可生成氧化钡、二氧化氮和氧气。
(1)酸溶时,硝酸可使FeO2-生成铁离子和水,反应的方程式为Ba(FeO2)2+8HNO3= Ba(NO3)2+2Fe(NO3)3+4H2O;
(2)硝酸具有强氧化性,能够使亚硫酸钡变为硫酸钡,同时生成NO气体,离子方程式为3BaSO3+2H++2NO3-= 3BaSO4+2NO↑+H2O;
(3)操作Ⅰ调pH=4~5,中和过量的硝酸,使溶液中的铁离子生成氢氧化铁沉淀;
(4) 过滤3所得母液为饱和的硝酸钡溶液,可加入到操作II中,继续使用,提高硝酸钡的产率;
(5)根据图像可知,第二步反应为NH3与NO3-反应生成氮气,发生反应的方程式为5NH3+3NO3-+3H+=4N2+9H2O,则消耗的NH3与NO3-的物质的量之比为5:3;
(6)硝酸钡受热分解生成氧化钡、二氧化氮和氧气,方程式为2Ba(NO3)2![]() 2BaO+4NO2↑+O2↑,标准状况下a L此混合气体溶于水可生成硝酸,其中
2BaO+4NO2↑+O2↑,标准状况下a L此混合气体溶于水可生成硝酸,其中![]() 为NO2,则生成硝酸的物质的量为
为NO2,则生成硝酸的物质的量为![]() mol,c=
mol,c=![]() mol/L。
mol/L。

【题目】已知某化学反应的平衡常数表达式为K=[c(CO2)·c(H2)] /[c(CO)·c(H2O)],在不同的温度下该反应的平衡常数值分别为:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
下列有关叙述错误的是
A. 该反应的化学方程式是:CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
B. 上述反应的正反应是放热反应
C. 如果在1L的密闭容器中加入CO2和H2各1mol,再把温度升高到830℃,此时测得CO2为0.4 mol时,该反应达到平衡状态
D. 若平衡浓度关系符合c(CO2)/3c(CO)=c(H2O)/5c(H2),可判断此时温度是1000℃