题目内容
13.下列化合物中,既有离子键,又有非极性键的是( )| A. | Na2O | B. | Ba(OH) 2 | C. | H2SO4 | D. | Na2O2 |
分析 活泼金属和活泼非金属元素之间易形成离子键,同种非金属元素之间易形成非极性键,不同非金属元素之间易形成极性键,据此分析解答.
解答 解:A.氧化钠中钠离子和氧离子之间只存在离子键,不含非极性键,故A错误;
B.氢氧化钡中钡离子和氢氧根离子之间存在离子键、O-H原子之间存在极性键,故B错误;
C.硫酸分子中S-O、O-H原子之间只存在共价键,故C错误;
D.过氧化钠中钠离子和过氧根离子之间存在离子键,过氧根离子中O-O原子之间存在非极性键,故D正确;
故选D.
点评 本题考查离子键和非极性键的判断,侧重考查基本概念,把握物质的构成微粒及微粒之间作用力即可解答,注意过氧化钠中存在的化学键及电子式的书写.

练习册系列答案
相关题目
3.某物质化学式为NH5,常温下是固态,能与水剧烈反应放出两种气体.在NH5中的各原子均具有稀有气体的稳定结构,则下列对NH5的描述中正确的是( )
| A. | NH5由分子构成 | B. | NH5属于离子化合物 | ||
| C. | NH5中N的化合价为-5价 | D. | NH5与水的反应是非氧化还原反应 |
4.向一密闭容器中充入1mol N2和3mol H2,在一定条件下发生反应(N2+3H2?2NH3).下列有关说法不正确的是( )
| A. | 达到化学平衡时,N2、H2和NH3的物质的量之比为1:3:2 | |
| B. | 达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 | |
| C. | 达到化学平衡时,N2不能完全转化为NH3 | |
| D. | 达到化学平衡时,容器中气体的总压强不再发生变化 |
1. (Ⅰ)用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:
(Ⅰ)用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:
(1)实验过程如图所示,分析判断:EF段化学反应速率最快.
(2)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是ACD
A.加入蒸馏水
B.加入浓盐酸
C.加入氯化钠溶液
D.降低反应体系的温度
(Ⅱ)以下是关于化学反应2SO2+O2?2SO3的两个素材:
素材1:某温度和压强下,不同时间点测得密闭体系中三种物质的物质的量浓度:
素材2:反应在不同条件下进行时SO2的转化率:
根据以上的两个素材回答问题:
(1)根据素材1中计算20~30s期间,用二氧化硫表示的化学反应平均速率为0.015mol/(L•s).
(2)根据素材2中分析得到,提高该化学反应限度的途径有降低温度、增大压强.
(3)若不考虑化学反应速率因素,仅根据素材2中分析,你认为硫酸厂能够取得最大经济效益需控制的反应条件是400℃、0.1MPa.
 (Ⅰ)用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:
(Ⅰ)用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:(1)实验过程如图所示,分析判断:EF段化学反应速率最快.
(2)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是ACD
A.加入蒸馏水
B.加入浓盐酸
C.加入氯化钠溶液
D.降低反应体系的温度
(Ⅱ)以下是关于化学反应2SO2+O2?2SO3的两个素材:
素材1:某温度和压强下,不同时间点测得密闭体系中三种物质的物质的量浓度:
| 时间(s) 物质的量浓度(mol/L) 物质 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| SO2 | 1 | 0.7 | 0.5 | 0.35 | 0.2 | 0.1 | 0.1 | 0.1 |
| O2 | 0.5 | 0.35 | 0.25 | 0.18 | 0.1 | 0.05 | 0.05 | 0.05 |
| SO3 | 0 | 0.3 | 0.5 | 0.65 | 0.8 | 0.9 | 0.9 | 0.9 |
| 压强 转化率 温度 | 0.1MPa | 0.5MPa | 1MPa | 10MPa |
| 400℃ | 99.2 | 99.6 | 99.7 | 99.9 |
| 500℃ | 93.5 | 96.9 | 97.8 | 99.3 |
| 600℃ | 73.7 | 85.8 | 90.0 | 96.4 |
(1)根据素材1中计算20~30s期间,用二氧化硫表示的化学反应平均速率为0.015mol/(L•s).
(2)根据素材2中分析得到,提高该化学反应限度的途径有降低温度、增大压强.
(3)若不考虑化学反应速率因素,仅根据素材2中分析,你认为硫酸厂能够取得最大经济效益需控制的反应条件是400℃、0.1MPa.
8.一定条件下反应2AB(g)?A2(g)+B2(g)达到平衡状态的标志是( )
| A. | 单位时间内生成nmolA2,同时消耗2n molAB | |
| B. | 容器中各组分的体积分数不随时间变化容器内 | |
| C. | AB的消耗速率等于A2的消耗速率 | |
| D. | 3种气体AB、A2、B2共存 |
18.NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,11.2 L的戊烷所含的分子0.5NA | |
| B. | 28 g乙烯所含共用电子对数目为4NA | |
| C. | 标准状况下,11.2 L二氯甲烷所含分子数为0.5 NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14 g,其原子数为3 NA |
5.某实验小组的同学想用碳酸钠溶液与饱和石灰水反应来制取氢氧化钠.
(1)该复分解反应发生的理由是氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,有沉淀生成,该反应能够发生;
(2)有人提出:实验时没有注意药品的用量,所得到的氢氧化钠溶液可能不纯.
猜想一:只含NaOH;
猜想二:含有NaOH和Na2CO3;
猜想三:含有NaOH和Ca(OH)2.
(3)为了验证猜想一成立,请你根据可选用的试剂,完成实验设计方案并填写以下表格.可选试剂:NaCl溶液、稀盐酸、Na2CO3溶液
(1)该复分解反应发生的理由是氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,有沉淀生成,该反应能够发生;
(2)有人提出:实验时没有注意药品的用量,所得到的氢氧化钠溶液可能不纯.
猜想一:只含NaOH;
猜想二:含有NaOH和Na2CO3;
猜想三:含有NaOH和Ca(OH)2.
(3)为了验证猜想一成立,请你根据可选用的试剂,完成实验设计方案并填写以下表格.可选试剂:NaCl溶液、稀盐酸、Na2CO3溶液
| 实验步骤 | 实验操作 | 预期现象及结论 |
| 1 | 取少量所得溶液于试管中, 再滴入几滴稀盐酸 | 若无气泡产生,证明原溶液中不含有Na2CO3 |
| 2 | 另取少量所得溶液于试管中, 再滴入几滴Na2CO3溶液 | 若无沉淀产生,结合步骤1,猜想一成立. |
17.用a、b、c、d四种金属进行如下图所示的实验,部分反应现象如下表所示,由此判断四种金属的活动性由强到弱的顺序是( )
| 实验装置 | 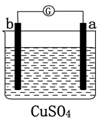 | 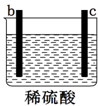 | 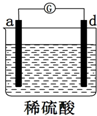 |
| 部分实验现象 | a极质量减少b极质量增加 | b极有气体产生c极无变化 | 电流从a极流向d极 |
| A. | abcd | B. | bcda | C. | dabc | D. | abdc |

 .
.