题目内容
12.将MgCl2•xH2O的晶体4.06g溶于水配成100mL溶液,此溶液100mL 0.4mol•L-1的AgNO3溶液完全反应.(1)4.06g的MgCl2•xH2O物质的量是多少摩尔?
(2)x的数值是多少?
分析 (1)根据n=C×V计算硝酸银的物质的量,根据MgCl2+2AgNO3=2AgCl↓+Mg(NO3)2计算50ml溶液中MgCl2的物质的量,进而计算100mL溶液中MgCl2的物质的量,MgCl2的物质的量等于MgCl2•xH2O的物质的量;
(2)根据M=$\frac{m}{n}$计算MgCl2•xH2O的摩尔质量,结合相对分子质量计算x的值.
解答 解:(1)50mL 0.4mol•L-1的AgNO3溶液n(AgNO3)=C×V=0.4mol•L-1×0.1L=0.04mol,
根据MgCl2+2AgNO3=2AgCl↓+Mg(NO3)2可知100ml溶液中MgCl2的物质的量为$\frac{1}{2}$n(AgNO3)=0.02mol,
答:4.06g的MgCl2•xH2O物质的量是0.02mol;
(2)MgCl2•xH2O的摩尔质量M=$\frac{m}{n}$=$\frac{4.06g}{0.02mol}$=203 g/mol,MgCl2•xH2O的相对分子质量为203,则203=18x+95,所以x=6,
答:x的数值是6.
点评 本题考查化学方程式有关计算,侧重于学生的分析能力和计算能力的考查,明确发生的反应理解化学方程式表示的意义是解答的关键,题目难度中等.

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
2.下列溶液中溶质的物质的量浓度为1mol•L-1的是( )
| A. | 将40g NaOH溶解于1L水中配成的NaOH溶液 | |
| B. | 常温常压下将22.4L HCl 气体溶于水配成1L的盐酸溶液 | |
| C. | 将100mL 10mol/L的浓盐酸加水900mL混合所配成的溶液 | |
| D. | 从1000mL 1mol/L NaCl溶液中取出100mL的溶液 |
3.下列说法正确的是( )
| A. | SiO2是酸性氧化物,它不溶于水也不溶于任何酸 | |
| B. | 木材浸过水玻璃后,具有防腐蚀性能且不易着火 | |
| C. | 因高温时SiO2与Na2CO3反应放出CO2,所以H2SiO3酸性比H2CO3强 | |
| D. | 氯气泄漏后,人应逆风且往低处跑 |
20.下列化合物分子中所有原子一定处于同一平面的是( )
| A. | 甲苯 | B. | 1-丁烯 | C. | 溴苯 | D. | 丙烯 |
7.在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质,下列实验现象和结论一致且正确的是( )
| A. | 加入有色布条,有色布条褪色,说明溶液中有氯气分子存在 | |
| B. | 溶液呈现黄绿色,且有刺激性气味,说明有氯气分子存在 | |
| C. | 先加入盐酸酸化,再加入硝酸银溶液产生白色沉淀,说明有Cl-存在 | |
| D. | 加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在 |
17.利用如图装置,可以模拟铁的电化学防护.下列关于该装置的叙述中正确的是( )
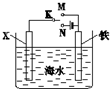

| A. | 若X为Zn时,则开关K置于M或N时均可减缓铁的腐蚀 | |
| B. | 若X为Cu时,为减缓铁的腐蚀,开关K应置于M处 | |
| C. | 若X为石墨、开关K置于M时,X电极上的反应为2H++2e-=H2↑ | |
| D. | 若X为石墨、开关K置于N时,铁电极上的反应为Fe-2e-=Fe2+ |
4.下列说法正确的是( )
| A. | 原电池的正极和电解池的阴极所发生的反应分别是氧化反应、还原反应 | |
| B. | 温度不变,用惰性电极电解饱和碳酸钠溶液,通电一段时间,溶液的浓度不变,有晶体析出 | |
| C. | 用惰性电极电解CuCl2溶液,一段时间后,要恢复原来的浓度,应加入固体CuSO4 | |
| D. | 以惰性电极电解CuSO4溶液,若阳极上产生的气体的物质的量为0.010mol,则阴极上析出Cu的质量为12.8g |
1.下列关于摩尔的说法中,正确的是( )
| A. | 摩尔是表示物质质量的单位 | |
| B. | 摩尔是国际七个基本物理量之一 | |
| C. | 用摩尔表示物质的量时,要用化学式指明粒子种类 | |
| D. | 摩尔既是物质的量的单位,又是粒子的数量单位 |
