题目内容
6.(Ⅰ)室温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如表所示:| 实验 编号 | HA的物质的量 浓度(mol/L) | NaOH的物质的 量浓度(mol/L) | 混合后 溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
(2)乙组混合溶液中c(A-)和c(Na+)的大小关系是C
A.前者大 B.后者大
C.二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+)
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
c(Na+)-c(A-)=10-4-10-10mol/L.
(Ⅱ)某二元酸(化学式用H2B表示)在水中的电离方程式是:
H2B═H++HB- HB-?H++B2-
回答下列问题:
(5)在0.1mol/L的Na2B溶液中,下列粒子浓度关系式正确的是AC.
A.c(B2-)+c(HB-)=0.1mol/L
B.c(B2-)+c(HB-)+c(H2B)=0.1mol/L
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)
( III)已知:25℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=1×10-9.
(6)医学上进行消化系统的X射线透视时,常使用BaSO4作内服造影剂.胃酸酸性很强(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是(用溶解平衡原理解释)对于平衡BaSO4(s)?Ba2+(aq)+SO42-(aq),H+不能减少Ba2+或SO42-的浓度,平衡不能向溶解方向移动.
万一误服了少量BaCO3,应尽快用大量0.5mol/L Na2SO4溶液给患者洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为2×10-10mol/L.
分析 (I)(1)等物质的量混合时,二者恰好反应生成盐,根据溶液的pH判断酸性强弱;
(2)任何溶液中都存在电荷守恒,根据电荷守恒判断;
(3)混合溶液的溶质为等物质的量的HA和NaA,pH>7说明A-的水解大于HA的电离,结合电荷守恒判断;
(4)由电荷守恒关系式变形得c(Na+)-c(A-)=c(OH-)-c(H+);
(II)(5)根据二元酸的电离方程式知,B2-只发生第一步水解,结合电荷守恒和物料守恒分析解答;
(Ⅲ)(6)从影响难溶电解质的溶解平衡的角度分析,结合溶度积计算.
解答 解:(1)若HA是强酸,恰好与NaOH溶液反应生成强酸强碱盐,pH=7;若HA是弱酸,生成的NaA水解显碱性,pH>7,故答案为:a=7时,HA是强酸;a>7时,HA是弱酸;
(2)混合溶液中存在电荷守恒c(Na+)+c(H+)=c(A-)+c(OH-),由于pH=7,则c(Na+)=c(A-),
故答案为:C;
(3)混合溶液的溶质为等物质的量的HA和NaA,pH>7说明A-的水解大于HA的电离,所以离子浓度由大到小的顺序为c(Na+)>c(A-)>c(OH-)>c(H+);
(4)由电荷守恒关系式变形得c(Na+)-c(A-)=c(OH-)-c(H+)=(10-4-10-10)mol•L-1,
故答案为:10-4-10-10;
(5)在Na2B中存在水解平衡:B2-+H2O=HB-+OH-,HB-不会进一步水解,所以溶液中没有H2B分子,
A.根据物料守恒得c(B2-)+c(HB-)=0.1mol•L-1,故A正确;
B.HB-不会进一步水解,所以溶液中没有H2B分子,故B错误;
C.根据质子守恒得c(OH-)=c(H+)+c(HB-),故C正确;
D.根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-),故D错误;
故答案为:AC;
(6)由平衡BaSO4(s)?Ba2+(aq)+SO42-(aq)可知,H+不能减少Ba2+或SO42-的浓度,平衡不能向溶解方向移动,c(SO42-)=0.5mol/L,则由c(Ba2+)×c(SO42-)=1×10-10,可知c(Ba2+)=2×10-10mol/L,
故答案为:对于平衡BaSO4(s)?Ba2+(aq)+SO42-(aq),H+不能减少Ba2+或SO42-的浓度,平衡不能向溶解方向移动;2×10-10.
点评 本题考查了弱电解质的电离、离子浓度大小的比较,明确弱电解质电离特点结合物料守恒、电荷守恒和质子守恒来分析解答解答,注意(5)中HB-不水解,为易错点.

| A. | 实验室用浓盐酸与MnO2反应制Cl2:MnO2+4HCl(浓)$\frac{\underline{\;△\;}}{\;}$Cl2↑+Mn2++2Cl-+2H2O | |
| B. | 向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至Ba2+刚好沉淀完全:Ba2++2OH-+H++${SO}_{4}^{2-}$+${NH}_{4}^{+}$═BaSO4↓+NH3•H2O+H2O | |
| C. | 向NaOH溶液中滴加同浓度的少量Ca(HCO3)2溶液:Ca2++${HCO}_{3}^{-}$+OH-═CaCO3↓+H2O | |
| D. | 将标准状况下112mL氯气通入10mL、1 mol/L的溴化亚铁溶液中:2Br-+Cl2═2Cl-+Br2 |
| A. |  ? ?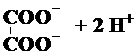 | B. | Ba(OH)2?Ba2++2OH- | ||
| C. | HCO3-+H2O?H3O++CO32- | D. | NaHCO3═Na++H++CO32- |
| A. | 0.5mol/L盐酸 | B. | 自来水 | ||
| C. | 0.5mol/L硫酸 | D. | 0.5mol/L 氢氧化钡 |
| A. | 向某溶液中加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,则原溶液中一定有CO32- | |
| B. | 向某溶液中加入氯化钡溶液有白色沉淀产生,再加稀硝酸,沉淀不消失,则原溶液中一定有Ag+ | |
| C. | 向某溶液中先加入盐酸酸化,没有明显现象,再加入BaCl2溶液,有白色沉淀产生,则原溶液中一定有SO42- | |
| D. | 向某溶液中加入加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,则原溶液一定有Ba2+ |
| A. | HCHO | B. | CH3OH | C. | HOOCCOOH | D. | 纤维素(C6H10O5)n |
 宇宙飞船上使用的氢氧燃料电池是一种新型化学电池,其构造如图所示,A、B是多孔性炭制成的两个电极,通入的气体由孔隙中逸出,并在电极表面放电.
宇宙飞船上使用的氢氧燃料电池是一种新型化学电池,其构造如图所示,A、B是多孔性炭制成的两个电极,通入的气体由孔隙中逸出,并在电极表面放电. 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图.该电池电池表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图.该电池电池表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答: