题目内容
X、Y是元素周期表前20号元素,且X的原子序数比Y大4.请填空:
Ⅰ.若X是金属元素,Y是非金属元素,X的氧化物、氯化物都是实验室常用的干燥剂.
(1)元素Y的原子结构示意图为 .
(2)含X的某盐与Y的气态氧化物都能作漂白剂,实验室保存该盐的方法是 .
Ⅱ.若X、Y同为第三周期元素,Y的离子半径在该周期离子中最小.
(3)乙烯与X单质反应的反应类型为 .
(4)广西治理龙江河镉(Cd2+)污染时,先向河中投入沉淀剂将Cd2+转化为难溶物,再投入X、Y形成的一种常见化合物,该化合物的作用是 (用必要的离子方程式和文字解释).
Ⅲ.若X是短周期最活泼的金属元素.
(5)Y2H4、O2与XOH溶液组成的电池,其负极的电极反应式(已知:Y2H4可以和O2反应生成Y2和H2O)为 .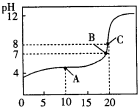
(6)25℃,用0.1000mol?L-1 XOH溶液滴定20.00mL0.1000mol?L-1某一元酸HA溶液所得滴定曲线如图.
①A、B、C三点所示溶液导电能力由强到弱顺序为 .
②估算25℃时HA的电离常数为 .
Ⅰ.若X是金属元素,Y是非金属元素,X的氧化物、氯化物都是实验室常用的干燥剂.
(1)元素Y的原子结构示意图为
(2)含X的某盐与Y的气态氧化物都能作漂白剂,实验室保存该盐的方法是
Ⅱ.若X、Y同为第三周期元素,Y的离子半径在该周期离子中最小.
(3)乙烯与X单质反应的反应类型为
(4)广西治理龙江河镉(Cd2+)污染时,先向河中投入沉淀剂将Cd2+转化为难溶物,再投入X、Y形成的一种常见化合物,该化合物的作用是
Ⅲ.若X是短周期最活泼的金属元素.
(5)Y2H4、O2与XOH溶液组成的电池,其负极的电极反应式(已知:Y2H4可以和O2反应生成Y2和H2O)为

(6)25℃,用0.1000mol?L-1 XOH溶液滴定20.00mL0.1000mol?L-1某一元酸HA溶液所得滴定曲线如图.
①A、B、C三点所示溶液导电能力由强到弱顺序为
②估算25℃时HA的电离常数为
分析:X、Y是元素周期表前20号元素,且X的原子序数比Y大4,
Ⅰ.若X是金属元素,Y是非金属元素,X的氧化物、氯化物都是实验室常用的干燥剂,则X为Ca元素,故Y为S元素,含X的某盐与Y的气态氧化物都能作漂白剂,则含X的盐为Ca(ClO)2,易与空中的水、二氧化碳反应;
Ⅱ.若X、Y同为第三周期元素,Y的离子半径在该周期离子中最小,则Y为Al元素、故X为Cl元素,
(3)氯气与乙烯发生加成反应;
(4)氯化铝水解生成氢氧化铝胶体,吸附Cd的难溶物而沉淀;
Ⅲ.若X是短周期最活泼的金属元素,则X为Na,故Y为N,
(5)N2H4、O2与NaOH溶液组成的电池,负极发生氧化反应,N2H4在负极放电,碱性条件下生成氮气与水;
(6)25℃,用0.1000mol?L-1 XOH溶液滴定20.00mL0.1000mol?L-1某一元酸HA溶液所得滴定曲线如图.
①由图可知,0.1mol/L的HA,其pH>1,则HA为弱酸,随NaOH溶液加入,由弱电解质转化为强电解质NaA,溶液中离子浓度增大,导电能力增强;
②加入20mLNaOH溶液恰好溶液,此时为NaA溶液,溶液pH=8,A-水解A-+H2O?HA+OH-,计算水解平衡常数Kh,HA的电离平衡Ka=
,据此计算.
Ⅰ.若X是金属元素,Y是非金属元素,X的氧化物、氯化物都是实验室常用的干燥剂,则X为Ca元素,故Y为S元素,含X的某盐与Y的气态氧化物都能作漂白剂,则含X的盐为Ca(ClO)2,易与空中的水、二氧化碳反应;
Ⅱ.若X、Y同为第三周期元素,Y的离子半径在该周期离子中最小,则Y为Al元素、故X为Cl元素,
(3)氯气与乙烯发生加成反应;
(4)氯化铝水解生成氢氧化铝胶体,吸附Cd的难溶物而沉淀;
Ⅲ.若X是短周期最活泼的金属元素,则X为Na,故Y为N,
(5)N2H4、O2与NaOH溶液组成的电池,负极发生氧化反应,N2H4在负极放电,碱性条件下生成氮气与水;
(6)25℃,用0.1000mol?L-1 XOH溶液滴定20.00mL0.1000mol?L-1某一元酸HA溶液所得滴定曲线如图.
①由图可知,0.1mol/L的HA,其pH>1,则HA为弱酸,随NaOH溶液加入,由弱电解质转化为强电解质NaA,溶液中离子浓度增大,导电能力增强;
②加入20mLNaOH溶液恰好溶液,此时为NaA溶液,溶液pH=8,A-水解A-+H2O?HA+OH-,计算水解平衡常数Kh,HA的电离平衡Ka=
| Kw |
| Kh |
解答:解:X、Y是元素周期表前20号元素,且X的原子序数比Y大4,
Ⅰ.若X是金属元素,Y是非金属元素,X的氧化物、氯化物都是实验室常用的干燥剂,则X为Ca元素,故Y为S元素,
(1)S原子核外有16个电子,有3个电子层,各层电子数为2、8、6,故原子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)含X的某盐与Y的气态氧化物都能作漂白剂,则含X的盐为Ca(ClO)2,易与空中的水、二氧化碳反应反应生成次氯酸,次氯酸不稳定分解而失效,故应密封保存,
故答案为:密封保存;
Ⅱ.若X、Y同为第三周期元素,Y的离子半径在该周期离子中最小,则Y为Al元素、故X为Cl元素,
(3)氯气与乙烯发生反应生成1,2-二氯乙烷,不饱和碳原子与氯原子结合,属于加成反应,
故答案为:加成反应;
(4)氯化铝溶于水发生水解Al3++3H2O?Al(OH)3+3H+,生成氢氧化铝胶体,吸附Cd的难溶物而沉淀,消除隔的污染,
故答案为:氯化铝溶于水发生水解Al3++3H2O?Al(OH)3+3H+,生成氢氧化铝胶体,吸附Cd的难溶物而沉淀,消除隔的污染;
Ⅲ.若X是短周期最活泼的金属元素,则X为Na,故Y为N,
(5)N2H4、O2与NaOH溶液组成的电池,负极发生氧化反应,N2H4在负极放电,碱性条件下生成氮气与水,负极电极反应式为:N2H4+4OH--4e-=N2↑+H2O,
故答案为:N2H4+4OH--4e-=N2↑+H2O;
(6)25℃,用0.1000mol?L-1 XOH溶液滴定20.00mL0.1000mol?L-1某一元酸HA溶液所得滴定曲线如图.
①由图可知,0.1mol/L的HA,其pH>1,则HA为弱酸,随NaOH溶液加入,由弱电解质转化为强电解质NaA,溶液中离子浓度增大,导电能力增强,故导电能力C>B>A,
故答案为:C>B>A;
②加入20mLNaOH溶液恰好溶液,此时为NaA溶液,浓度为0.05mol/L,A-水解A-+H2O?HA+OH-,溶液pH=8,则c(OH-)≈c(HA)=10-6mol/L,c(A-)≈0.05mol/L,则A-水解平衡常数Kh=
=2×10-11,则HA的电离平衡Ka=
=
=5×10-4,
故答案为:5×10-4.
Ⅰ.若X是金属元素,Y是非金属元素,X的氧化物、氯化物都是实验室常用的干燥剂,则X为Ca元素,故Y为S元素,
(1)S原子核外有16个电子,有3个电子层,各层电子数为2、8、6,故原子结构示意图为
 ,故答案为:
,故答案为: ;
;(2)含X的某盐与Y的气态氧化物都能作漂白剂,则含X的盐为Ca(ClO)2,易与空中的水、二氧化碳反应反应生成次氯酸,次氯酸不稳定分解而失效,故应密封保存,
故答案为:密封保存;
Ⅱ.若X、Y同为第三周期元素,Y的离子半径在该周期离子中最小,则Y为Al元素、故X为Cl元素,
(3)氯气与乙烯发生反应生成1,2-二氯乙烷,不饱和碳原子与氯原子结合,属于加成反应,
故答案为:加成反应;
(4)氯化铝溶于水发生水解Al3++3H2O?Al(OH)3+3H+,生成氢氧化铝胶体,吸附Cd的难溶物而沉淀,消除隔的污染,
故答案为:氯化铝溶于水发生水解Al3++3H2O?Al(OH)3+3H+,生成氢氧化铝胶体,吸附Cd的难溶物而沉淀,消除隔的污染;
Ⅲ.若X是短周期最活泼的金属元素,则X为Na,故Y为N,
(5)N2H4、O2与NaOH溶液组成的电池,负极发生氧化反应,N2H4在负极放电,碱性条件下生成氮气与水,负极电极反应式为:N2H4+4OH--4e-=N2↑+H2O,
故答案为:N2H4+4OH--4e-=N2↑+H2O;
(6)25℃,用0.1000mol?L-1 XOH溶液滴定20.00mL0.1000mol?L-1某一元酸HA溶液所得滴定曲线如图.
①由图可知,0.1mol/L的HA,其pH>1,则HA为弱酸,随NaOH溶液加入,由弱电解质转化为强电解质NaA,溶液中离子浓度增大,导电能力增强,故导电能力C>B>A,
故答案为:C>B>A;
②加入20mLNaOH溶液恰好溶液,此时为NaA溶液,浓度为0.05mol/L,A-水解A-+H2O?HA+OH-,溶液pH=8,则c(OH-)≈c(HA)=10-6mol/L,c(A-)≈0.05mol/L,则A-水解平衡常数Kh=
| 10-6×10-6 |
| 0.05 |
| Kw |
| Kh |
| 10-14 |
| 2×10-11 |
故答案为:5×10-4.
点评:本题目综合性较大,涉及元素化合物推断、常用化学用语、盐类水解、原电池、中和滴定、电解质溶液平衡常数有关计算等,(6)为易错点、难点,注意电解质溶液导电性与溶液中离子浓度及电荷有关、注意掌握盐类水解常数与酸(碱)电离常数的关系.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目




