题目内容
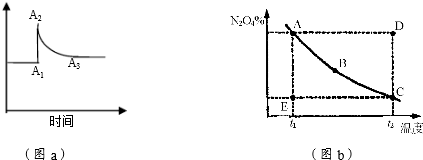
7.用化学平衡理论研究2NO2?N2O4的反应体系,对硝酸的工业生产有现实意义.图a和图b分别表示不同条件下在密闭容器中该反应体系的化学平衡情况.回答下列问题:(1)该反应的平衡常数表达式为K=$\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$,在密闭容器中,当其他条件不变的情况下,向已平衡的反应体系中充入N2O4,K不变(填“变大”、“变小”或“不变”),平衡向逆反应方向移动;
(2)图a表示恒温条件下体系中c(NO2)的变化情况.由A1→A2,c(NO2)变化的原因是容器体积减小,浓度增大;由A2→A3,c(NO2)变化的原因是平衡向右移动,浓度减小;
(3)图b表示在恒压条件下,平衡体系中N2O4的质量分数随温度的变化情况(实线上的任意一点为对应温度下的平衡状态).
①A、B、C、D、E各对应状态中,v(正)>v(逆)的是E;
②维持t1不变,E→A所需时间为x,维持t2不变,D→C所需时间为y,则x>y(“<”、“>”或“=”).
分析 (1)平衡常数只随温度变化,不随物质浓度变化,加入四氧化二氮是增大生成物浓度,平衡逆向进行;
(2)反应前后是气体体积减小的反应,二氧化氮浓度急剧增大后减小,说明是缩小容器体积,增大压强平衡正向进行;
(3)①D点要达平衡,必须降低Y的百分含量,也就是逆向建立平衡,E点要到达平衡,必须升高Y的百分含量,正向建立平衡,A、B、C三点都在平衡线上,所以此三点的正逆反应速率相等;
②温度越高反应速率越大,反应达到平衡时间越短.
解答 解:(1)平衡常数只随温度变化,不随物质浓度变化,加入四氧化二氮是增大生成物浓度,平衡逆向进行,当其他条件不变的情况下,向已平衡的反应体系中充入N2O4,K值不变,平衡逆向进行,
故答案为:不变;逆反应;
(2)分析图象和化学方程式可知,反应前后是气体体积减小的反应,二氧化氮浓度急剧增大后减小,说明是缩小容器体积,增大压强平衡正向进行,图a表示恒温条件下体系中c(NO2)的变化情况.由A1→A2,c(NO2)变化的原因是容器体积减小,浓度增大,由A2→A3,c(NO2)变化的原因是平衡向右移动,浓度减小,
故答案为:容器体积减小,浓度增大;平衡向右移动,浓度减小;
(3)①A、B、C三点都在平衡线上,所以此三点的正逆反应速率相等,D点要达平衡,必须降低Y的百分含量,也就是逆向建立平衡,从而得出v(正)<v(逆),E点要达平衡,必须提高Y的百分含量,也就是正向建立平衡,从而得出v(正)>v(逆);
故答案为:E;
②温度越高反应速率越大,反应达到平衡时间越短,因为t1<t2,所以x>y,故答案为:>.
点评 本题考查了化学平衡的建立,平衡影响因素的分析判断,图象变化曲线的特征理解应用,掌握基础是关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
18.将煤转化为水煤气的方法是通过化学高温方法将煤转化为洁净燃料的方法之一,煤转化为水煤气的主要反应为C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2.有关物质的燃烧热数据如表所示:
已知:1mol H2O(g)转化为1mol H2O放出44.0kJ的热量.
①写出C完全燃烧的热化学方程式C(s)+O2(g)=CO2(g)△H=-393.5 kJ/mol;
②相同条件下,相同体积的氢气与一氧化碳完全燃烧,放出热量较多的是H2;
③写出煤转化为水煤气的主要反应的热化学方程式:C(s)+H2O(g)=CO(g)+H2(g)△H=+87.5kJ/mol.
| 物质 | C | H2 | CO |
| △H/kJ•mol-1 | -393.5 | -285.8 | -283.0 |
①写出C完全燃烧的热化学方程式C(s)+O2(g)=CO2(g)△H=-393.5 kJ/mol;
②相同条件下,相同体积的氢气与一氧化碳完全燃烧,放出热量较多的是H2;
③写出煤转化为水煤气的主要反应的热化学方程式:C(s)+H2O(g)=CO(g)+H2(g)△H=+87.5kJ/mol.
15.下列化合物中,既可看作醇,又可看作酚的是( )
| A. |  | B. |  | C. |  | D. |  |
2.下列有关物质的性质和该性质的应用均正确的是( )
| A. | 氧化铝具有很高的熔点,故可用于制造耐高温材料 | |
| B. | 常温下铝与浓硫酸不发生反应,故常温下可用铝制容器贮运浓硫酸 | |
| C. | 碳酸钠可与盐酸反应,故常用于治疗胃溃疡病人的胃酸过多症 | |
| D. | 二氧化硫、潮湿的氯气均具有漂白性,故两者混合使用漂白效果会更好 |
12.关于氢元素的叙述,不正确的是( )
| A. | 自然界中氢元素有三种同位素,它们的性质相同 | |
| B. | 三种同位素在化学反应中容易失去一个电子而呈+1价 | |
| C. | ${\;}_{1}^{1}$H原子失去一个电子后变成一个质子 | |
| D. | 氢在周期表中与碱金属同属ⅠA族 |
19.下列物质中属于含有极性键的非极性分子的是( )
| A. | CS2 | B. | H2O | C. | CH3CH2Cl | D. | NH3 |
16.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述不正确的是( )


| A. | 反应开始到10s,用Z表示的反应速率为0.079mol/(L•s) | |
| B. | 该反应的方程式为:X(g)+Y(g)?2 Z(g) | |
| C. | 反应开始到10s时,Y的转化率为79.0% | |
| D. | 反应进行到10s时,该反应达到限度且各组分浓度相等 |
17.下列实验操作能达到目的是( )
| A. | 用Na2S溶液和Al2(SO4)3溶液反应制取Al2S3固体 | |
| B. | 加热蒸发K2CO3溶液获得K2CO3晶体 | |
| C. | 加热蒸发FeCl2溶液制取Fe(OH)2固体 | |
| D. | 加热蒸发MgCl2溶液制取MgCl2固体 |