题目内容
8.下列条件下,两种气体分子数一定不相等的是( )| A. | 相同质量、不同密度的N2O和CO2 | |
| B. | 相同体积、相同密度的CO和C2H4 | |
| C. | 相同温度、相同压强、相同体积的O2和O3 | |
| D. | 相同压强、相同温度、相同质量的O2和SO2 |
分析 根据N=nNA可知,气体分子数目不相等,则二者物质的量不相等.
A.根据n=$\frac{m}{M}$判断;
B.根据m=ρV,n=$\frac{n}{M}$判断;
C.同温同压下,体积之比等于物质的量之比;
D.根据n=$\frac{m}{M}$判断.
解答 解:根据N=nNA可知,气体分子数目不相等,则二者物质的量不相等.
A.N2O和CO2的摩尔质量相等为44g/mol,二者质量相等,根据n=$\frac{m}{M}$可知二者物质的量相等,含有的分子数目一定相等,故A不选;
B.根据m=ρV可知,相同体积、相同密度的CO和C2H4的质量相等,二者摩尔质量都是28g/mol,根据n=$\frac{m}{M}$可知,二者物质的量相等,含有的分子数目一定相等,故B不选;
C.相同温度、相同压强、相同体积的O2和O3的物质的量之相等,含有分子数目一定相等,故C不选;
D.O2和SO2的摩尔质量不同,根据根据n=$\frac{m}{M}$可知,二者物质的量不同,含有分子数目不同,故D选,
故选:D.
点评 本题考查阿伏伽德罗定律及推论,难度不大,注意利用pV=nRT理解阿伏伽德罗定律及推论.

练习册系列答案
相关题目
18.关于摩尔质量的叙述正确的是( )
| A. | 氢气的摩尔质量是2克 | |
| B. | 1摩尔任何物质的质量通常叫做该物质的摩尔质量 | |
| C. | 1摩尔H2SO4的质量是98克/摩 | |
| D. | 氢气的摩尔质量是1g/mol |
19.某同学做了如下两个实验:①将少量氯气通入FeI2与淀粉的混合溶液中,溶液变蓝色;②将少量氯气通入到FeBr2与KSCN的混合溶液中溶液变红色.由上述实验可以得出的结论是( )
| A. | 氧化性:Cl2>Fe3+>Br2>I2 | |
| B. | ②发生反应Fe2++Cl2=Fe3++2Cl- | |
| C. | 实验中只有氯气发生氧化反应 | |
| D. | 实验②发生的反应中,有一个是非氧化还原反应 |
16. 电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电后,发现左侧溶液变蓝色,一段时间后,蓝色又逐渐变浅.(已知:3I2+6OH-═IO3-+5I-+3H2O,IO3-离子无色);下列说法不正确的是( )
电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电后,发现左侧溶液变蓝色,一段时间后,蓝色又逐渐变浅.(已知:3I2+6OH-═IO3-+5I-+3H2O,IO3-离子无色);下列说法不正确的是( )
 电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电后,发现左侧溶液变蓝色,一段时间后,蓝色又逐渐变浅.(已知:3I2+6OH-═IO3-+5I-+3H2O,IO3-离子无色);下列说法不正确的是( )
电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电后,发现左侧溶液变蓝色,一段时间后,蓝色又逐渐变浅.(已知:3I2+6OH-═IO3-+5I-+3H2O,IO3-离子无色);下列说法不正确的是( )| A. | 右侧发生的电极反应式:2H2O+2e-═H2↑+2OH- | |
| B. | a为电源正极 | |
| C. | 电解结束时,右侧溶液中没有IO3- | |
| D. | 用阴离子交换膜,电解槽内发生的总化学方程式为:KI+3H2O$\frac{\underline{\;电解\;}}{\;}$ KIO3+3H2↑ |
3.历史上最早应用的还原性染料--靛蓝,其结构简式如图所示,下列关于靛蓝的叙述中不正确的是( )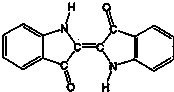

| A. | 靛蓝由碳、氢、氧、氮四种元素组成 | B. | 它的分子式是C16H10N2O2 | ||
| C. | 该物质是天然高分子化合物 | D. | 靛蓝中含苯环,属于芳香化合物 |
20. 某烷烃主链上有4个碳原子的同分异构体有2种,含有相同碳原子数且主链上也是4个碳原子的单烯烃的同分异构体有( )
某烷烃主链上有4个碳原子的同分异构体有2种,含有相同碳原子数且主链上也是4个碳原子的单烯烃的同分异构体有( )
 某烷烃主链上有4个碳原子的同分异构体有2种,含有相同碳原子数且主链上也是4个碳原子的单烯烃的同分异构体有( )
某烷烃主链上有4个碳原子的同分异构体有2种,含有相同碳原子数且主链上也是4个碳原子的单烯烃的同分异构体有( )| A. | 4种 | B. | 3种 | C. | 5种 | D. | 7种 |
17.类推的思维方法在化学学习与研究中常会产生错误的结论,因此类推的结论最终要经过实践的检验才能确定其是否正确.下列几种类推结论中正确的是( )
| A. | 由2Cu+O2$\frac{\underline{\;△\;}}{\;}$2CuO可推出同族的硫也有Cu+S$\frac{\underline{\;△\;}}{\;}$CuS | |
| B. | Fe3O4可表示为FeO•Fe2O3,则Pb3O4可表示为PbO•Pb2O3 | |
| C. | Na能与水反应生成H2,K、Ca也能与水反应生成H2 | |
| D. | CO2与Na2O2反应只生成Na2CO3和O2,故SO2与Na2O2反应只生成Na2SO3和O2 |

 已知2NO2(g)═N2O4(g)△H(298K)=-52.7kJ•mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
已知2NO2(g)═N2O4(g)△H(298K)=-52.7kJ•mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验: