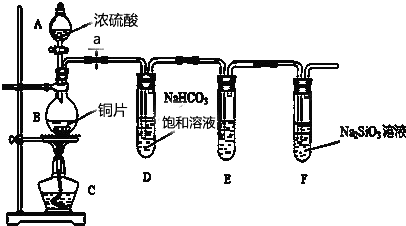
题目内容
6.用“>”或“<”回答下列问题(1)酸性:H2CO3>H2SiO3 H2SiO3<H3PO4
(2)碱性:Ca(OH)2>Mg(OH)2 Mg(OH)2> Al(OH)3
(3)气态氢化物的稳定性:H2O> H2S H2S<HCl
(4)还原性:H2O< H2S H2S>HCl
(5)酸性:H2SO4> H2SO3 HClO4>HClO.
分析 (1)非金属性越强,对应最高价氧化物水化物的酸性越强;
(2)金属性越强,对应最高价氧化物水化物的碱性越强;
(3)非金属性越强,氢化物越稳定;
(4)非金属性越强,对应氢化物的还原性越弱;
(5)同种元素的含氧酸,非羟基氧原子个数越多,酸性越强.
解答 解:(1)非金属性C>Si、P>Si,则酸性为H2CO3>H2SiO3、H2SiO3<H3PO4,故答案为:>;<;
(2)金属性Ca>Mg>Al,碱性:Ca(OH)2>Mg(OH)2、Mg(OH)2>Al(OH)3,故答案为:>;>;
(3)非金属性O>S、Cl>S,则稳定性为H2O>H2S、H2S<HCl,故答案为:>;<;
(4)非金属性O>S、Cl>S,则还原性为H2O<H2S、H2S>HCl,故答案为:<;>;
(5)同种元素的含氧酸,非羟基氧原子个数越多,酸性越强,硫酸、高氯酸均为强酸,亚硫酸、次氯酸均为弱酸,则酸性为H2SO4>H2SO3、HClO4>HClO,
故答案为:>;>.
点评 本题考查元素周期表及应用,为高频考点,把握元素的位置、非金属性和金属性比较等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.下列分子式表示的有机物的同分异构体共有四种的是(不考虑立体异构)( )
| A. | C3H7Cl | B. | C3H6Cl2 | C. | C3H5Cl3 | D. | C3HCl7 |
17.对11→17号元素性质的描述正确的是( )
| A. | 原子半径和简单离子半径减小 | |
| B. | 氧化物对应的水化物碱性减弱,酸性增强 | |
| C. | 14号元素的高纯单质可制光电池 | |
| D. | 单质的熔点降低 |
11.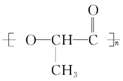 在国际环境问题中,使用一次性聚苯乙烯材料带来的“白色污染”极为严重,因为这种材料难分解,处理麻烦.最近科学家研制出了一种新材料(如图)能代替聚苯乙烯,它是由乳酸(一种有机羟基羧酸)缩聚而成,能在乳酸菌的作用下降解而消除对环境的污染.下列关于聚乳酸的说法正确的是( )
在国际环境问题中,使用一次性聚苯乙烯材料带来的“白色污染”极为严重,因为这种材料难分解,处理麻烦.最近科学家研制出了一种新材料(如图)能代替聚苯乙烯,它是由乳酸(一种有机羟基羧酸)缩聚而成,能在乳酸菌的作用下降解而消除对环境的污染.下列关于聚乳酸的说法正确的是( )
 在国际环境问题中,使用一次性聚苯乙烯材料带来的“白色污染”极为严重,因为这种材料难分解,处理麻烦.最近科学家研制出了一种新材料(如图)能代替聚苯乙烯,它是由乳酸(一种有机羟基羧酸)缩聚而成,能在乳酸菌的作用下降解而消除对环境的污染.下列关于聚乳酸的说法正确的是( )
在国际环境问题中,使用一次性聚苯乙烯材料带来的“白色污染”极为严重,因为这种材料难分解,处理麻烦.最近科学家研制出了一种新材料(如图)能代替聚苯乙烯,它是由乳酸(一种有机羟基羧酸)缩聚而成,能在乳酸菌的作用下降解而消除对环境的污染.下列关于聚乳酸的说法正确的是( )| A. | 聚乳酸是一种纯净物 | |
| B. | 聚乳酸是一种羧酸 | |
| C. | 聚乳酸的单体 | |
| D. | 其聚合方式与聚苯乙烯的聚合方式相同 |
18.在含有大量的Na+、OH-、NO3-,该溶液中还可能大量存在的离子是( )
| A. | NH4+ | B. | H+ | C. | SO42- | D. | Mg2+ |
15.下列说法中正确的是( )
| A. | 废旧轮胎均可直接在室外焚烧处理 | |
| B. | 电木可溶于酒精 | |
| C. | 聚氯乙烯属于吸水性高分子树脂 | |
| D. | 复合材料玻璃钢具有强度高、质量轻等优点 |
16.下列中心原子的杂化轨道类型和分子几何构型均正确的是( )
| A. | CS2中C原子sp2杂化,为V形 | |
| B. | BCl3中B原子sp2杂化,为三角锥形 | |
| C. | C2H2分子中,C为sp2杂化,为直线形 | |
| D. | PCl2中P原子sp2杂化,为平面三角形 |