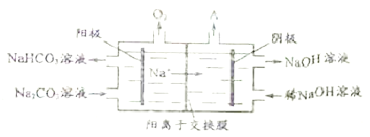
题目内容
【题目】已知甲和乙为中学化学常见金属单质,丙和丁为常见气体单质,A~E为常见化合物;A为淡黄色固体,常温下B为液体,C的焰色反应为黄色。试回答下列问题:
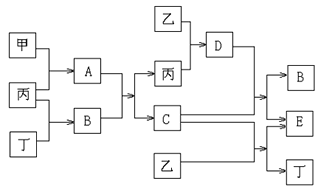
(1)A和E的化学式分别为_____________、____________;
(2)A+B→C+丙的化学方程式:__________________________________________ ;
(3)D+C→B+E的化学方程式:__________________________________________ ;
(4)1mol甲和1mol乙混合投入到足量的B中,在标准状况下,最多能产生丁气体______L。
【答案】Na2O2 NaAlO2 2 Na2O2+2H2O═4 NaOH +O2↑ Al2O3+2NaOH=2NaAlO2+H2O 44.8L
【解析】
A为淡黄色固体,A是过氧化钠,金属甲与气体单质丙反应生成过氧化钠,则甲是金属钠、丙是氧气;常温下B为液体,B是水,过氧化钠与水反应生成氢氧化钠和氧气,C是氢氧化钠;丁为常见气体单质,与氧气反应生成水,丁为氢气;乙为中学化学常见金属单质,能与氢氧化钠反应放出氢气,则乙是铝、E是偏铝酸钠;铝与氧气反应生成氧化铝,D是氧化铝。
(1)根据以上分析,A为淡黄色固体,A是过氧化钠,乙为中学化学常见金属单质,能与氢氧化钠反应放出氢气,则乙是铝、E是偏铝酸钠,所以A和E的化学式分别为Na2O2 、NaAlO2;(2)过氧化钠与水反应生成氢氧化钠和氧气,化学方程式是2 Na2O2+2H2O═4 NaOH +O2↑;(3)氧化铝和氢氧化钠反应生成偏铝酸钠和水,化学方程式是Al2O3+2NaOH=2NaAlO2+H2O;(4)) 1mol钠与水反应生成0.5mol氢气和1mol NaOH, 铝和氢氧化钠反应的方程式是![]() ,1mol铝和1mol氢氧化钠恰好反应生成1.5mol氢气,所以在标准状况下,最多能产生氢气的体积(标准状况)是
,1mol铝和1mol氢氧化钠恰好反应生成1.5mol氢气,所以在标准状况下,最多能产生氢气的体积(标准状况)是![]() 44.8L L。
44.8L L。