题目内容
在某一溶液中,含有NH+4、I-、Ba2+、Cl-等离子,则该溶液的pH和介质可以是
- A.pH=12,氨水为介质
- B.pH=8,次氯酸钠溶液为介质
- C.pH=3,H2SO4溶液为介质
- D.pH=1,稀硝酸为介质
分析:A.该条件下离子能够大量共存;
B.次氯酸跟离子与碘离子发生反应;
C.硫酸根离子与钡离子发生反应;
D.酸性溶液中碘离子、硝酸根离子发生氧化还原反应.
解答:A.pH=12,氨水为介质时,该组离子之间不反应,则能够大量共存,故A正确;
B.pH=8,次氯酸钠溶液为介质时,次氯酸跟离子与碘离子发生氧化还原反应,则不能共存,故B错误;
C.pH=3,H2SO4溶液为介质时,硫酸根离子与钡离子发生反应,则不能共存,故C错误;
D.pH=1,稀硝酸为介质时,酸性溶液中碘离子、硝酸根离子发生氧化还原反应,则不能共存,故D错误;
故选A.
点评:本题考查离子的共存,熟悉信息及离子之间的反应是解答本题的关键,题目难度不大.

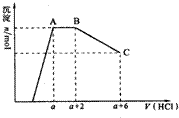 某10mL溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、K+、Na+、Fe3+、Mg2+、Al3+等离子,向溶液中逐滴加入1mol/L的盐酸,生成沉淀物质的量与加入盐酸体积的关系如图所示,下列说法中正确的是( )
某10mL溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、K+、Na+、Fe3+、Mg2+、Al3+等离子,向溶液中逐滴加入1mol/L的盐酸,生成沉淀物质的量与加入盐酸体积的关系如图所示,下列说法中正确的是( )| A、原溶液肯定含有OH-,CO32-,AlO2-,SiO32-,Na+ | ||
B、若原溶液中只含有某一种阳离子(不考虑水电离出引厂来的氢离子)且忽略反应前后溶液体积变化,那么该离子在原溶液中的物质的量浓度为
| ||
| C、n(CO32-):n(AlO2-)=3:4 | ||
| D、a值肯定等于4 |
(15分)某无色溶液中可能含有NH4+、K+、Al3+、HCO3—、Cl—、MnO4—、SO42—等离子中的几种离子。
①经实验可知溶液明显呈酸性,且焰色反应呈现出紫色。
②取10mL该溶液于试管中滴加Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀,向滤液中加入AgNO3溶液未见沉淀产生。
③另取少量该溶液于试管中,滴加NaOH溶液产生白色沉淀,当沉淀增加到一定量后开始产生气体,最后沉淀完全溶解。
(1)该溶液中一定不含有 (填离子的化学式)离子,一定含有的离子有 (填离子的化学式);
(2)在这些不存在的离子中,有一种离子在酸性环境中和碱性环境中都不能存在,试写出该离子与酸反应的离子方程式: ;
(3)为确定上述溶液中所含的各种离子的物质的量,取100mL上述溶液并向其中加入Na2O2固体,产生的沉淀和气体与所加Na2O2固体物质的量的关系曲线如图Ⅰ:
 |
①该溶液中焰色反应呈现紫色的离子的物质的量为: mol,
②写出n(Na2O2)=0.2mol时反应的总离子方程式: ;
(4)将0.1mol明矾晶体与等物质的量的某无水盐晶体X混合后溶解于水中,所得溶液与上述溶液所含离子种类完全相同。若向该溶液中加入Ba(OH)2溶液,所得沉淀的物质的量与所加入Ba(OH)2的物质的量的关系如图Ⅱ:
 |
试根据图像推断①X的化学式: ,②图像中A点溶液中的离子成分和物质的量分别是: ;

 (1)某混合溶液中,可能含有的离子如下表:
(1)某混合溶液中,可能含有的离子如下表:

