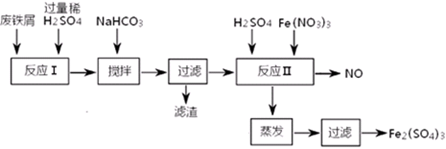
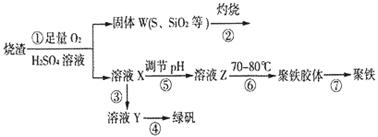
题目内容
用足量的CO还原14 g铁的氧化物的混合物,将生成的气体通入足量的澄清石灰水中,生成沉淀25 g,则这种混合物组成是①FeO、Fe2O3 ②FeO、Fe3O4 ③Fe2O3、Fe3O4中的 ,其物质的量之比为 。
①或③ 1∶2或1∶1
混合物中Fe、O原子个数比为:
则两种化合物中,必有一种 ,另一种
,另一种 ,故混合物是①或③,物质的量之比为1∶2或1∶1。
,故混合物是①或③,物质的量之比为1∶2或1∶1。

则两种化合物中,必有一种
 ,另一种
,另一种 ,故混合物是①或③,物质的量之比为1∶2或1∶1。
,故混合物是①或③,物质的量之比为1∶2或1∶1。
练习册系列答案
相关题目