题目内容
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.1molCl2和足量的铁加热条件下反应,转移电子数一定为3NA
B.常温常压下,8.8g CO2和N2O的混合气体所含电子数为4.4 NA
C.常温下,PH=13的Ba(OH)2 溶液,0.1L,含OH﹣ , 0.02NA
D.1 L 1 mol/L的乙醇水溶液中含有氢原子总数为6NA
【答案】B
【解析】解:A.氯气单质是强氧化剂,能将变价金属氧化到高价态,铁与氯气反应,2Fe+3Cl2 ![]() 2FeCl3 , 铁从0价变为+3价,1mol铁失去3mol电子,电子数为N=n×NA=3×NA=3NA , 但需1.5mol氯气,1molCl2与足量的铁反应,电子转移依据氯气计算,电子转移为2mol,电子数为N=n×NA=2×NA=2NA , 故A错误;
2FeCl3 , 铁从0价变为+3价,1mol铁失去3mol电子,电子数为N=n×NA=3×NA=3NA , 但需1.5mol氯气,1molCl2与足量的铁反应,电子转移依据氯气计算,电子转移为2mol,电子数为N=n×NA=2×NA=2NA , 故A错误;
B.CO2和N2O的摩尔质量相同,都是44g/mol,则8.8gCO2和N2O的物质的量为: ![]() =0.2mol,二者都含有22个电子,则0.2mol混合气体中含有的电子的物质的量为:22×0.2mol=4.4mol,混合气体中所含的电子数为4.4NA , 故B正确;
=0.2mol,二者都含有22个电子,则0.2mol混合气体中含有的电子的物质的量为:22×0.2mol=4.4mol,混合气体中所含的电子数为4.4NA , 故B正确;
C.0.10L pH=13的Ba(OH)2溶液中OH﹣的数目=0.1L×0.1mol/L×NA=0.01NA , 故C错误;
D.1 L 1 mol/L的乙醇水溶液中含乙醇1mol,水中含有氢原子,含有的氢原子总数大于6NA , 故D错误;
故选B.

 中考解读考点精练系列答案
中考解读考点精练系列答案【题目】碳、及其化合物在生产中有重要应用。
(1)设反应 ① Fe(s) + CO2(g)![]() FeO(s) + CO(g) ⊿H = Q1 平衡常数为K1
FeO(s) + CO(g) ⊿H = Q1 平衡常数为K1
② Fe(s) + H2O(g)![]() FeO(s) + H2(g) ⊿H = Q2 平衡常数为K2
FeO(s) + H2(g) ⊿H = Q2 平衡常数为K2
不同温度下,K1、K2的值如下表
T/K | K1 | K2 |
973 | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
现有反应 ③ H2(g) + CO2(g)![]() CO(g) + H2O(g) ⊿H = Q3,结合上表数据,根据反应①、②推导出Q1、Q2、Q3的关系式Q3=_____________,反应③是________(填“放”或“吸”)热反应。
CO(g) + H2O(g) ⊿H = Q3,结合上表数据,根据反应①、②推导出Q1、Q2、Q3的关系式Q3=_____________,反应③是________(填“放”或“吸”)热反应。
(2)已知CO2催化加氢合成乙醇的反应原理为:2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g) ⊿H <0
C2H5OH(g)+3H2O(g) ⊿H <0
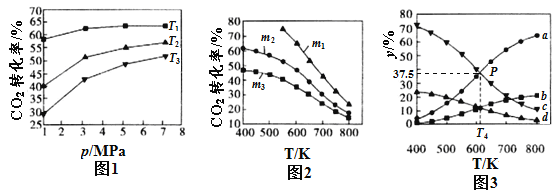
①图l、图2分别是CO2的平衡转化率随压强及温度的变化关系,已知m为起始时的投料比,即m=n(H2)/n(CO2),图l中投料比相同,温度从高到低的顺序为________,图2中m1、m2、m3从大到小的顺序为_____________。
②图3表示在总压为5MPa的恒压条件下,且m=3时,平衡状态时各物质的物质的量分数与温度的关系。则曲线d代表的物质为________(填化学式),T4温度时,该反应的平衡常数Kp=________。(提示:用平衡分压代替平衡浓度来计算,某组分平衡分压=总压×该组分的物质的量分数,结果保留小数点后三位)
