题目内容
19.下列各组离子中,在碱性溶液中能大量共存,且溶液为无色透明的是( )| A. | K+、Mn${O}_{4}^{-}$、Cl-、${SO}_{4}^{2-}$ | B. | Na+、${CO}_{3}^{2-}$、${SO}_{4}^{2-}$、Cl- | ||
| C. | ${NO}_{3}^{-}$、Na+、${HCO}_{3}^{-}$、Mg2+ | D. | Na+、${NO}_{3}^{-}$、H+、${SO}_{4}^{2-}$ |
分析 溶液无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,碱性溶液中存在大量的氢氧根离子,
A.高锰酸根离子为有色离子,不满足溶液无色的条件;
B.四种离子之间不反应,都不与氢氧根离子反应,且为无色溶液;
C.镁离子、碳酸氢根离子与氢氧根离子反应;
D.氢离子与氢氧根离子反应.
解答 解:无色溶液可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,碱性溶液中存在大量的氢氧根离子,
A.MnO4-为有色离子,不满足溶液无色的要求,故A错误;
B.Na+、CO32-、SO42-、Cl-之间不反应,都是无色离子,都不与氢氧根离子反应,在溶液中能够大量共存,故B正确;
C.Mg2+、HCO3-与氢氧根离子反应,在溶液中不能大量共存,故C错误;
D.H+与氢氧根离子反应生成水,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的判断,为中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间; 能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
9.列有关物质的性质或应用的说法不正确的是( )
| A. | 二氧化硅是生产光纤制品的基本原料 | |
| B. | 水玻璃可用于生产黏合剂和防火剂 | |
| C. | Na2O、Na2O2与CO2反应产物相同 | |
| D. | SiO2是酸性氧化物,能与NaOH溶液反应 |
7.下列离子方程式书写正确的是( )
| A. | Cu溶于足量浓硝酸:Cu+2NO3-+4H+═Cu2++2NO2↑+2H2O | |
| B. | 氧化亚铁加入稀硝酸中:FeO+2H+=Fe2++H2O | |
| C. | 氨水吸收过量的SO2:OH-+SO2=HSO3- | |
| D. | 碳酸钙溶于醋酸中:CaCO3+2H+=Ca2++H2O+CO2↑ |
14.把0.05mol NaOH固体分别加入到下列100mL液体中,溶液导电性变化较大的是( )
| A. | 0.5mol/L盐酸 | B. | 自来水 | ||
| C. | 0.5mol/L硫酸 | D. | 0.5mol/L 氢氧化钡 |
4.下列有关说法正确的是( )
| A. | AlCl3溶液蒸干、灼烧至恒重,最终剩余固体是AlCl3 | |
| B. | 在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 | |
| C. | 将纯水加热至较高温度,KW变大、pH变小、呈酸性 | |
| D. | 锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去 |
11.对于某些离子的检验及结论一定正确的是( )
| A. | 向某溶液中加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,则原溶液中一定有CO32- | |
| B. | 向某溶液中加入氯化钡溶液有白色沉淀产生,再加稀硝酸,沉淀不消失,则原溶液中一定有Ag+ | |
| C. | 向某溶液中先加入盐酸酸化,没有明显现象,再加入BaCl2溶液,有白色沉淀产生,则原溶液中一定有SO42- | |
| D. | 向某溶液中加入加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,则原溶液一定有Ba2+ |
4.碳的化合物与人类生产、生活密切相关.
I.工业上先将煤转化为CO,再利用CO和水蒸气反应制H2时,发生以下反应:CO(g)+H2O(g)?CO2(g)+H2(g)
(1)向1L恒容密闭容器中充入CO(g)和H2O(g),t℃时测得部分数据如下表.
则该温度下反应的平衡常数K=$\frac{2}{3}$.
(2)相同温度下,若向该容器中充入l molCO、x molH2O(g)、y molCO2、2molH2,此时v(正)=v(逆),则x、y的关系式是x:y=3:1.
Ⅱ.在一恒温、恒容密闭容器中发生反应:Ni(s)+4CO(g)$?_{180-200℃}^{50-80℃}$Ni(CO)4(g),则△H<0,(填“>”、“<”);缩小容器容积,平衡向右(填“左”或“右”)移动,△H不变(填“增大”、“减少”或“不变”,下同),混合气体的密度增大.
I.工业上先将煤转化为CO,再利用CO和水蒸气反应制H2时,发生以下反应:CO(g)+H2O(g)?CO2(g)+H2(g)
(1)向1L恒容密闭容器中充入CO(g)和H2O(g),t℃时测得部分数据如下表.
| T/min | 0 | 1 | 2 | 3 | 4 |
| n(H2O)/mol | 1 | 0.8 | 0.65 | 0.6 | 0.6 |
| n(CO)/mol | 0.8 | 0.6 | 0.45 | 0.4 | 0.4 |
(2)相同温度下,若向该容器中充入l molCO、x molH2O(g)、y molCO2、2molH2,此时v(正)=v(逆),则x、y的关系式是x:y=3:1.
Ⅱ.在一恒温、恒容密闭容器中发生反应:Ni(s)+4CO(g)$?_{180-200℃}^{50-80℃}$Ni(CO)4(g),则△H<0,(填“>”、“<”);缩小容器容积,平衡向右(填“左”或“右”)移动,△H不变(填“增大”、“减少”或“不变”,下同),混合气体的密度增大.
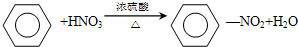 ,该反应的类型是取代反应.
,该反应的类型是取代反应.