题目内容
20.写出下列化学反应的离子方程式①氢氧化钡溶液和硫酸溶液反应Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
②碳酸钙和足量稀盐酸反应CaCO3+2H+=Ca2++CO2↑+H2O
③氧化铁和稀盐酸反应:Fe2O3+6H+=2Fe3++3H2O
④少量金属钠加到冷水中:2Na+2H2O=2Na++2OH-+H2↑.
分析 ①氢氧化钡与硫酸溶液反应生成硫酸钡沉淀和水;
②碳酸钙与稀盐酸反应生成氯化钙、二氧化碳气体和水;
③氧化铁与稀盐酸反应生成氯化铁和水;
④Na与水反应生成氢氧化钠和氢气.
解答 解:①氢氧化钡溶液与硫酸溶液反应生成难溶物硫酸钡和水,反应的离子方程式为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,
故答案为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O;
②碳酸钙与稀盐酸反应的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O,
故答案为:CaCO3+2H+=Ca2++CO2↑+H2O;
③氧化铁与稀盐酸反应生成氯化铁和水,氧化铁需要保留化学式,反应的离子方程式为:Fe2O3+6H+=2Fe3++3H2O,
故答案为:Fe2O3+6H+=2Fe3++3H2O;
④金属钠与氢气反应生成氢气和NaOH,反应的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,
故答案为:2Na+2H2O=2Na++2OH-+H2↑.
点评 本题考查了离子方程式的书写,题目难度不大,明确发生反应实质为解答关键,注意掌握离子方程式的书写原则,试题有利于提高学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
5.对应燃烧热概念的说法正确的是( )
| A. | 不一定是放热 | B. | 可燃物不一定是1mol | ||
| C. | 单位不一定是KJ | D. | 可燃物不一定是气体 |
12.下列叙述中,不正确的是( )
| A. | 甲苯与氯气在光照下反应主要生成2,4-二氯甲苯 | |
| B. | 苯与浓硝酸、浓硫酸共热并保持55-60℃反应生成硝基苯 | |
| C. | 苯乙烯在合适条件下催化加氢可生成乙基环己烷 | |
| D. | 乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷 |
9.下列反应中,不属于氧化还原反应的是( )
| A. | 2 H2O2$\frac{\underline{\;催化剂\;}}{\;}$2 H2O+O2↑ | B. | 2 Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3 H2O | ||
| C. | Fe2O3+3 CO$\frac{\underline{\;高温\;}}{\;}$2 Fe+3 CO2 | D. | Cl2+H2O═HCl+HclO |
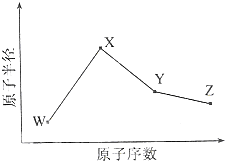 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.