题目内容
14.将2.5g由Na2CO3、NaHCO3和NaOH组成的固体混合物加入足量水溶解配成溶液.然后向此溶液中逐渐滴加1.0mol/L的盐酸.所加盐酸的体积与产生的CO2的体积关系如图: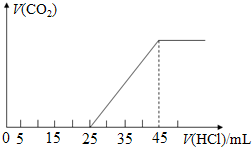
(1)该溶液中存在的溶质是Na2CO3、NaOH(填化学式).
(2)0~25mL加入盐酸时发生反应的离子方程式为H++OH-═H2O;CO32-+H+═HCO3-.
(3)当加入40mL盐酸时,产生CO2的体积为336mL(标准状况).
(4)固体加水溶解后的溶液中正盐的物质的量为0.02mol.
分析 (1)固体在溶液中发生反应为:NaHCO3+NaOH=Na2CO3+H2O;结合图象可知,开始没有二氧化碳气体生成,固体组成可能为:①Na2CO3、NaOH(NaOH过量),②Na2CO3、NaHCO3(NaOH少量),若为①Na2CO3、NaOH,0~25mL段消耗盐酸体积会大于25~45mL段,与图象一致;若为②Na2CO3、NaHCO3,0~25mL段发生反应为:CO32-+H+═HCO3-,25~45mL段发生反应为:HCO3-+H+═CO2↑+H2O,则0~25mL段消耗盐酸体积会应该小于25~45mL段,与图象不一致;
(2)溶质为碳酸钠和氢氧化钠,0~25mL段先发生酸碱中和,再发生碳酸钠与盐酸反应生成碳酸氢钠与氯化钠;
(3)结合图象可知,当加入40mL盐酸时,25~34mL发生碳酸氢钠与盐酸的反应生成二氧化碳气体,根据反应方程式及盐酸的物质的量计算出生成二氧化碳气体的体积;
(4)溶解后溶质为碳酸钠和氢氧化钠,其中正盐为碳酸钠,根据25~45mL段消耗盐酸的量和质量守恒可计算出碳酸钠的物质的量.
解答 解:(1)在溶液中碳酸氢钠与氢氧化钠反应生成碳酸钠,发生反应为:NaHCO3+NaOH=Na2CO3+H2O;结合图象可知,开始没有二氧化碳气体生成,固体组成可能为:①Na2CO3、NaOH(NaOH过量),②Na2CO3、NaHCO3(NaOH少量),若为①Na2CO3、NaOH,0~25mL段消耗盐酸体积会大于25~45mL段,与图象一致;若为②Na2CO3、NaHCO3,0~25mL段发生反应为:CO32-+H+═HCO3-,25~45mL段发生反应为:HCO3-+H+═CO2↑+H2O,则0~25mL段消耗盐酸体积会应该小于25~45mL段,与图象不一致,所以制成的稀溶液中的溶质为:Na2CO3、NaOH,
故答案为:Na2CO3、NaOH;
(2)0~25mL段先发生酸碱中和,反应的离子反应方程式为:H++OH-═H2O,再发生碳酸钠与盐酸反应生成碳酸氢钠与氯化钠,其离子反应方程式为:CO32-+H+═HCO3-,
故答案为:H++OH-═H2O;CO32-+H+═HCO3-;
(3)结合图象可知,当加入40mL盐酸时,25~34mL发生碳酸氢钠与盐酸的反应生成二氧化碳气体,
设生成二氧化碳的物质的量为n,生成气体时消耗的酸的物质的量为(40-25)×10-3L×1mol•L-1=0.015mol,则
HCO3-+H+═CO2↑+H2O
1 1
0.015mol n
则n=0.015mol,标况下二氧化碳的体积为:22.4L/mol×0.015mol=0.336L=336mL,
故答案为:336;
(4)固体溶于水后溶质为氢氧化钠和碳酸钠的混合物,其中正盐为碳酸钠,根据25~45mL段发生的反应HCO3-+H+═CO2↑+H2O可知,碳酸钠的物质的量为:(45-25)×10-3L×1mol•L-1=0.02mol,
故答案为:0.02.
点评 本题考查离子方程式的有关计算,题目难度中等,明确反应的先后顺序及图象中每段图象对应的化学反应是解答本题的关键,试题培养了学生的分析能力及化学计算能力.

 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案| A. | 在酸性条件下,CH3CO18OC2H5水解的产物是CH3CO18OH和C2H5OH | |
| B. | 用甘氨酸(H2NCH2COOH)和丙氨酸(CH3CHNH2COOH)混合缩合,最多可形成4种二肽 | |
| C. | 苯甲醛中混有苯甲酸,加入生石灰,再加热蒸馏 | |
| D. | 将电石与饱和食盐水反应生成的气体通入溴的四氯化碳溶液中,若溶液褪色,证明有乙炔生成 |
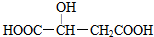 ,下列说法错误的是( )
,下列说法错误的是( )| A. | 苹果酸中能发生酯化反应的官能团有2种 | |
| B. | 苹果酸能发生取代反应、消去反应和缩聚反应 | |
| C. | 1 mol苹果酸最多可与1 mol Na2CO3发生复分解反应 | |
| D. | 与苹果酸官能团种类和个数均相同的同分异构体还有两种 |
| R | W | |
| X | Y | Z |
| A. | R、W、Y的原子半径依次增大 | |
| B. | R、X、Y的简单氢化物的稳定性依次增强 | |
| C. | W、Y、Z形成的单核阴离子还原性依次增强 | |
| D. | X、Y、Z的最高价氧化物对应水化物的酸性依次增强 |
| A. | 钠放在空气中易被氧气氧化为过氧化钠,因此应保存在水面下 | |
| B. | 钠是强还原剂,它能从水溶液中置换出金属活动顺序表中钠后面的金属 | |
| C. | 钠蒸气充入灯泡中制成钠灯,常用于航海灯塔照明 | |
| D. | 金属钠着火时,能用水来灭火 |
| A. | 1H2和2H2互为同位素 | |
| B. | CH3-CH2-OH与CH3-O-CH3互为同分异构体 | |
| C. | 乙烯和乙炔是同系物 | |
| D. | ${\;}_{8}^{16}O$、${\;}_{8}^{17}O$、${\;}_{8}^{18}O$互为同素异形体 |
| A. | 分馏石油得到的各个馏分都是纯净物 | |
| B. | 石油的裂解是为了提高汽油等轻质油的产量和质量 | |
| C. | 煤中含有苯、甲苯、二甲苯等有机化合物 | |
| D. | 不沾锅的表面涂覆的聚四氟乙烯是一种有机高分子材料 |
| A. | 冰和乙酸的混合物俗称冰醋酸 | |
| B. | 具有酸的通性 | |
| C. | 酸性比碳酸的酸性强 | |
| D. | 与乙醇反应生成的有机物是乙酸乙酯 |