题目内容
【题目】如图所示是25℃时,N2与H2反应过程中能量变化的曲线图,下列叙述正确的是
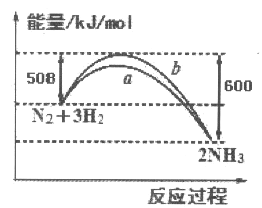
A. 该反应为放热反应
B. b曲线是表示加入了催化剂时的能量变化曲线
C. 加入催化剂,增加了反应的热效应
D. 反应开始通入1 mol N2和3 mol H2,反应后放出的热量一定为92kJ
【答案】A
【解析】
该反应放出的能量大于吸收的能量,所以放热,△H=放出的能量-吸收的能量=600kJ/mol-508kJ/mol=92kJ/mol;其中曲线a是反应的活化能降低了,反应的焓变不变。
A.该反应放出的能量大于吸收的能量,所以该反应为放热反应,故A正确;
B. 曲线a是反应的活化能降低了,反应的焓变不变,所以是加入了催化剂所致,故B错误;
C. 反应体系中加入催化剂,不改变反应的始终态,则不会改变反应的热效应,故C错误;
D. 向密闭容器中通入1mol N2和3mol H2,不可能完全转化,所以达到平衡时放出热量小于92kJ,故D错误;
故答案选A。

【题目】在1L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) ![]() M(g)+N(g),所得实验数据如下表,下列说法不正确的是
M(g)+N(g),所得实验数据如下表,下列说法不正确的是
实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(X) | n(Y) | n(M) | ||
① | 700 | 0.10 | 0.10 | 0.09 |
② | 800 | 0.20 | 0.20 | 0.10 |
③ | 900 | 0.10 | 0.15 | a |
A. 正反应为放热反应
B. 实验①中,若5min时测得n(M)=0.05mol,则0~5min时间内,用N表示的平均反应速率v(N)= 0.01mol/(Lmin)
C. 实验②中,该反应的平衡常数K=1.0
D. 实验③中,达到平衡时,a大于0.06
【题目】下列实验操作、现象以及结论完全对应的是
实验操作 | 实验现象 | 结论 | |
A | 0.1 mol/L MgSO4溶液中滴加过量NaOH 溶液,再滴加 0.1 mol/L CuSO4溶液 | 先生成白色沉淀,后变为浅蓝色沉淀 | Cu(OH)2溶度积比Mg(OH)2小 |
B | 将水蒸气通过灼热的铁粉 | 铁粉变为红色 | 铁可以与水在高温下发生反应 |
C | 向酸性KMnO4溶液中滴加乙醇 | 溶液褪色 | 乙醇具有还原性 |
D | 向FeCl3和BaCl2混合溶液中通入足量SO2 | 溶液变为浅绿色且有白色沉淀生成 | Fe3+被还原为Fe2+,白色沉淀为BaSO3 |
A. AB. BC. CD. D
