题目内容
【题目】如图所示为气相直接水合法中乙烯的平衡转化率与温度、压强的关系[其中n(H2O)∶n(C2H4)=1∶1]
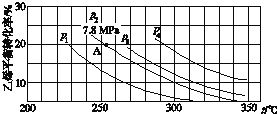
①列式计算乙烯水合制乙醇反应在图中A点的平衡常数Kp=__(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数);
②图中压强(p1、p2、p3、p4)的大小顺序为___,理由是___。
③气相直接水合法常采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290℃,压强6.9MPa,n(H2O)∶n(C2H4)=0.6∶1,乙烯的转化率为5%,若要进一步提高乙烯转化率,除了可以适当改变反应温度和压强外,还可采取的措施有___、___。
【答案】0.072 P1<P2<P3<P4 反应分子数减少,相同温度下,压强升高乙烯转化率提高 将产物乙醇液化转移去 增加n(H2O):n(C2H4)的比
【解析】
①依据题意建立三段式,结合Kp公式计算可得;
②该反应是气体体积减小的反应,增大压强,平衡向正反应方向移动;
③若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有改变物质的浓度。
①乙烯与水反应的化学方程式为C2H4(g)+H2O(g)![]() C2H5OH(g),设C2H4、H2O的起始物质的量分别为1mol,由图可知A点乙烯转化率为20%,由此建立如下三段式:
C2H5OH(g),设C2H4、H2O的起始物质的量分别为1mol,由图可知A点乙烯转化率为20%,由此建立如下三段式:
C2H4(g)+H2O(g)![]() C2H5OH(g)
C2H5OH(g)
开始(mol) 1 1 0
转化(mol) 0.2 0.2 0.2
平衡(mol) 0.8 0.8 0.2
由三段式所得数据可知,平衡时C2H4、H2O、C2H5OH的平衡分压分别为![]() ×7.8MPa、
×7.8MPa、![]() ×7.8MPa、
×7.8MPa、![]() ×7.8Mpa,则平衡常数Kp=
×7.8Mpa,则平衡常数Kp=![]() ≈0.072,故答案为:0.072;
≈0.072,故答案为:0.072;
②由图可知,在相同的温度下由于乙烯是平衡转化率是P1<P2<P3<P4,该反应是气体体积减小的反应,增大压强,平衡向正反应方向移动,乙烯的转化率提高,则压强关系是P1<P2<P3<P4,故答案为:P1<P2<P3<P4;
③若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有改变物质的浓度,如从平衡体系中将产物乙醇分离出去,或增大水蒸气的浓度,改变二者的物质的量的比等,故答案为:将产物乙醇液化转移去,增加n(H2O):n(C2H4)的比。

【题目】氟代硼酸钾(KBe2BO3F2)是激光器的核心材料,我国化学家在此领域的研究走在了世界的最前列。回答下列问题:
(1)氟代硼酸钾中各元素原子的第一电离能大小顺序是F>O>____________。基态K+电子占据最高能级的电子云轮廓图为________形。
(2)NaBH4是有机合成中常用的还原剂,其中的阴离子空间构型是_______,中心原子的杂化形式为_______。NaBH4中存在_____(填标号)。
a. 离子键 b.氢键 c.σ键 d.π键
(3)BeCl2中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的BeCl2的结构式为________,其中Be的配位数为_______。
(4)第三周期元素氟化物的熔点如下表:
化合物 | NaF | MgF2 | AlF3 | SiF4 | PF5 | SF6 |
熔点/℃ | 993 | 1261 | 1291 | -90 | -83 | -50.5 |
解释表中氟化物熔点变化的原因:_____________________。
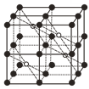
(5)CaF2的一种晶胞如图所示。Ca2+占据F-形成的空隙,其空隙率是________。若r(F-)=xpm,r(Ca2+)=ypm,设阿伏加德罗常数的值为NA,则CaF2的密度ρ=_________ g·cm-3(列出计算表达式)。