题目内容
下列说法正确的是
| A.N和As属于第VA族元素,N原子得电子能力比As原子强 |
| B.族序数等于其周期序数的元素一定是金属元素 |
| C.元素周期表中,位于金属和非金属交界线附近的元素属于过渡元素 |
| D.Si、S、Cl的最高价氧化物都能与水反应生成相应的酸,且酸性依次增强 |
A
解析试题分析:A、N和As属于第VA族元素,同主族元素自上而下非金属性逐渐减弱,所以N原子得电子能力比As原子强,A正确;B、族序数等于其周期序数的元素不一定是金属元素,例如第一正确第IA族的氢元素是非金属,B不正确;C、元素周期表中,位于金属和非金属交界线附近的元素一般既具有金属性,还具有非金属性。过渡元素是指周期表中第8、9、10三列的元素,C不正确;D、二氧化硅与水不反应,D不正确,答案选A。
考点:考查元素周期表的结构和元素周期律的应用

 科学实验活动册系列答案
科学实验活动册系列答案根据不同的研究目的,可以编制成不同的元素周期表。将前18号元素按原子序数递增的顺序排列,可形成如图所示的“蜗牛”元素周期表,图中每个“.”代表一种元素,其中P点代表氢元素(图中的字母不表示元素符号)。下列说法正确的是
| A.Y点元素对应的氢化物比z点元素对应的氢化物更稳定 |
| B.虚线相连的两个点元索处于同一族 |
| C.比Y点原子序数小8的元素,它的最高氧化物对应的水化物是一种弱酸 |
D.K、L、X三种元素的离子半径大小顺序是X3+> >K2- >K2- |
短周期主族元素X、Y、Z、W的原子序数依次增大,元素X的原子半径最小,Y元素和X元素在一定条件下能形成YX,Z和W的原子序数相差8,W原子的电子总数是其电子层数的5倍。下列叙述正确的是
| A.Y可用于制造高性能可充电电池 |
| B.WX3的沸点高于ZX3 |
| C.W的最高价含氧酸的酸性强于Z的最高价含氧酸的酸性 |
| D.原子半径的大小顺序: rZ>rY>rX |
下表是元素周期表的一部分,有关说法正确的是( )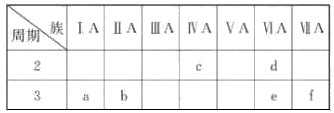
| A.e的氢化物比d的氢化物稳定 |
| B.a、b、e三种元素的原子半径:e>b>a |
| C.6种元素中,c元素单质的化学性质最活泼 |
| D.c、e、f的最高价氧化物对应的水化物的酸性依次增强 |
13153I是常规核裂变产物之一,可以通过测定大气或水中13153I的含量变化来检测核电站是否发生放射性物质泄漏。下列有关13153I的叙述中错误的是( )
| A.13153I的化学性质与12753I相同 |
| B.13153I的原子序数为53 |
| C.13153I的原子核外电子数为78 |
| D.13153I的原子核内中子数多于质子数 |
下列说法中肯定不正确的是( )
①某原子K层上只有1个电子
②某原子M层上的电子数为L层上电子数的4倍
③某离子M层上和L层上的电子数均为K层的4倍
④某离子的核电荷数与最外层电子数相等
| A.①③ | B.② | C.③④ | D.④ |
短周期元素X、Y、Z、W的原子序数依次增大,X是形成化合物最多的元素且X常见化合价为+1和-1,Y原子最外层电子数是次外层的3倍;Z与X处于同一主族,W的原子序数是Y的2倍。下列叙述不正确的是( )
| A.原子半径的大小顺序:rZ>rW>rY>rX |
| B.元素Y的简单气态氢化物的热稳定性比W的弱 |
| C.化合物Z2Y2与X2Y反应时,Z2Y2既是氧化剂又是还原剂 |
| D.由X、Y、Z、W四种元素组成的化合物其水溶液一定显酸性 |
根据中学化学教材所附元素周期表判断,下列叙述正确的是( )
| A.L电子层电子数为奇数的所有元素都是非金属 |
| B.第三、四、五、六周期元素的数目分别是8、18、32、32 |
| C.由左至右第8、9、10三列元素中没有非金属元素 |
| D.只有第ⅡA族元素的原子最外层有2个电子 |