题目内容
部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如下处理:

下列说法正确的是( )

下列说法正确的是( )
| A.滤液A中的阳离子为Fe2+、Fe3+、H+ |
| B.样品中Fe元素的质量为2.14g |
| C.样品中CuO的质量为4.0g |
| D.V=448 |
A、生成的滤渣3.2g是铜,金属铜可以和三价铁反应,所以一定不含有价铁离子,故A错误;
B、固体为三氧化二铁,其物质的量为
=0.02mol,铁元素的量为0.02mol×2=0.04mol,质量为:0.04mol×56g/mol=2.24g,故B错误;
C、根据B的答案知道铁元素质量=2.24g,而原来固体才5.76g,所以CuO质量不超过5.76-2.24=3.52g,故C错误;
D、根于最后溶液中溶质为过量H2SO4和FeSO4,而铁元素物质的量为0.04mol,说明参加反应硫酸物质的量为0.04mol,含氢离子0.08mol,其中部分氢离子生成氢气,另外的H+和合金中的氧结合成水了,由于合金中氧物质的量
=0.02mol,它结合氢离子0.04mol,所以硫酸中有0.08-0.04=0.04molH+生成氢气,即生成0.02mol氢气,标况体积为448ml,故D正确.
故选D.
B、固体为三氧化二铁,其物质的量为
| 3.2g |
| 160g/mol |
C、根据B的答案知道铁元素质量=2.24g,而原来固体才5.76g,所以CuO质量不超过5.76-2.24=3.52g,故C错误;
D、根于最后溶液中溶质为过量H2SO4和FeSO4,而铁元素物质的量为0.04mol,说明参加反应硫酸物质的量为0.04mol,含氢离子0.08mol,其中部分氢离子生成氢气,另外的H+和合金中的氧结合成水了,由于合金中氧物质的量
| (5.76-3.2-2.24)g |
| 16g/mol |
故选D.

练习册系列答案
相关题目
部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.76g,如图所示流程处理,下列说法中,正确的是( )
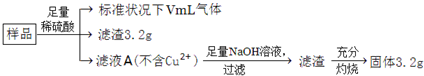
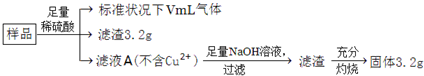
| A、滤液A中阳离子为Fe2+、H+ | B、样品中金属Fe的质量为2.24g | C、样品中CuO的质量为4.0g | D、V=448 |



