题目内容
【题目】砷元素广泛存在于自然界,砷与其化合物被运用在农药、除草剂、杀虫剂等。
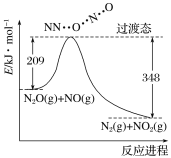
(1)砷的常见氧化物有 As2O3 和 As2O5,其中 As2O5 热稳定性差。根据图 1 写出 As2O5 分解为 As2O3 的热化学方程式_________________。

(2)砷酸钠具有氧化性,298 K 时,在 100 mL 烧杯中加入 10 mL 0.1 mol/L Na3AsO4 溶液、20 mL 0.1 mol/L KI 溶液和 20 mL 0.05 mol/L硫酸溶液,发生下列反应:AsO43-(无色)+2I-+2H+ ![]() AsO33-(无色)+I2(浅黄色)+H2O ΔH。测得溶液中 c(I2)与时间(t)的关系如图 2 所示(溶液体积变化忽略不计)。
AsO33-(无色)+I2(浅黄色)+H2O ΔH。测得溶液中 c(I2)与时间(t)的关系如图 2 所示(溶液体积变化忽略不计)。
①下列情况表明上述可逆反应达到平衡状态的是_______(填字母代号)。
a.溶液颜色保持不再变化 b.c(AsO33-)+c(AsO43-)不再变化
c.AsO43-的生成速率等于 I2 的生成速率 d.![]() 保持不再变化
保持不再变化
②0~10 min 内,I的反应速率 v(I)=_______。
③在该条件下,上述反应的平衡常数 K=______。
④升高温度,溶液中 AsO43-的平衡转化率减小,则该反应的 ΔH______0(填“大于”“小于”或“等于”)。
(3)雄黄(As4S4)在空气中加热至 300℃时会生成两种氧化物,其中一种氧化物为剧毒的砒霜(As2O3), 另一种氧化物为______(填化学式),可用双氧水将 As2O3 氧化为 H3AsO4 而除去,写出该反应的化学方 程式_________。
【答案】As2O5(s)=As2O3(s)+O2(g ) △H=+295.4 kJ/mol ac 0.003 mol/(L·min) 4.5×106 L3/mol3 小于 SO2 2H2O2+H2O+As2O3=2H3AsO4
【解析】
(1)As2O5分解为As2O3需要吸收的热量为-619kJ/mol-(-914.6kJ/mol)=+295.4 kJmol-1,以此书写热化学方程式;
(2)①根据反应到达平衡状态时,正逆反应速率相等,平衡时各物质的浓度、百分含量不变分析判断;②根据v=![]() 计算;③计算平衡状态下的浓度,结合平衡常数K=
计算;③计算平衡状态下的浓度,结合平衡常数K=![]() 计算;④升高温度,AsO43-的平衡转化率减小,说明平衡逆向进行;
计算;④升高温度,AsO43-的平衡转化率减小,说明平衡逆向进行;
(3)雄黄在空气中加热至300℃时会 两种氧化物,其中一种氧化物为剧毒的砒霜(As2O3),依据原子守恒可知另一种氧化物为二氧化硫,过氧化氢中氢元素化合价-1价变化为-2价,As元素化合价+3价变化为+5价,结合电子守恒和原子守恒写出该反应的化学方程式。
(1)由图象可知,As2O5分解为As2O3需要吸收的热量为-619kJ/mol-(-914.6kJ/mol) =+295.4 kJmol-1,则热化学方程式As2O5(s)=As2O3(s)+O2(g) △H=+295.4 kJmol-1,故答案为:As2O5(s)=As2O3(s)+O2(g) △H=+295.4kJmol-1;
(2)①AsO43-(无色)+2I-+2H+ ![]() AsO33-(无色)+I2(浅黄色)+H2O。a.溶液颜色不再变化,说明碘的浓度不变,反应达到平衡状态,故a正确;b.根据原子守恒可知,c(AsO33-)+c(AsO43-)始终不变,不能说明反应达到平衡状态,故b错误;c.AsO43-的生成速率等于I2的生成速率,说明正逆反应速率相等,反应达到平衡状态,故c正确;d.根据方程式,AsO33-和I2的物质的量相同,
AsO33-(无色)+I2(浅黄色)+H2O。a.溶液颜色不再变化,说明碘的浓度不变,反应达到平衡状态,故a正确;b.根据原子守恒可知,c(AsO33-)+c(AsO43-)始终不变,不能说明反应达到平衡状态,故b错误;c.AsO43-的生成速率等于I2的生成速率,说明正逆反应速率相等,反应达到平衡状态,故c正确;d.根据方程式,AsO33-和I2的物质的量相同,![]() =1,始终保持不变,不能说明反应达到平衡状态,故d错误;故答案为:ac;
=1,始终保持不变,不能说明反应达到平衡状态,故d错误;故答案为:ac;
②图2可知,I2浓度变化为0.015mol/L,I-浓度变化0.03mol/L,0-10min,v(I-)=![]() =0.003mol/(Lmin),故答案为:0.003mol/(Lmin);
=0.003mol/(Lmin),故答案为:0.003mol/(Lmin);
③

K═![]() =4.5×106 L3/mol3,故答案为:4.5×106 L3/mol3;
=4.5×106 L3/mol3,故答案为:4.5×106 L3/mol3;
④升高温度,AsO43-的平衡转化率减小,说明平衡逆向进行,正反应为放热反应,△H小于0,故答案为:小于;
(3)雄黄在空气中加热至300℃时会 两种氧化物,其中的一种氧化物为剧毒的砒霜(As2O3),由原子守恒可知反应为As4S4+7O2 ![]() 2As2O3+4SO2,另一种氧化物为二氧化硫,双氧水将As2O3氧化为H3AsO4而除去,氧化还原反应中过氧化氢中氢元素化合价-1价变化为-2价,As元素化合价+3价变化为+5价,结合电子守恒和原子守恒写出该反应的化学方程式为2H2O2+H2O+As2O3=2H3AsO4,故答案为:SO2;2H2O2+As2O3+H2O=2H3AsO4。
2As2O3+4SO2,另一种氧化物为二氧化硫,双氧水将As2O3氧化为H3AsO4而除去,氧化还原反应中过氧化氢中氢元素化合价-1价变化为-2价,As元素化合价+3价变化为+5价,结合电子守恒和原子守恒写出该反应的化学方程式为2H2O2+H2O+As2O3=2H3AsO4,故答案为:SO2;2H2O2+As2O3+H2O=2H3AsO4。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案