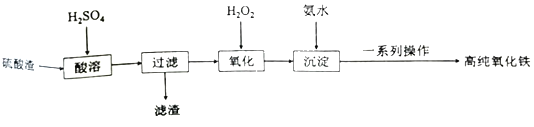
题目内容
【题目】下列有关化学用语表示正确的是( )
A.硅的原子结构示意图:
B.中子数为10的氧原子:![]() O
O
C.漂白粉有效成分的化学式;CaClO
D.NaHCO3在水溶液中的电离方程式:NaHCO3=Na++H++CO32﹣
【答案】A
【解析】
A.硅原子质子数为14,核外有14个电子;
B.质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数;
C.漂白粉的有效成分是次氯酸钙;
D.![]() 是强碱弱酸酸式盐,在水溶液中完全电离生成
是强碱弱酸酸式盐,在水溶液中完全电离生成![]() 、
、![]() 。
。
A.硅原子的核电荷数、核外电子总数为14,故原子结构示意图为 ,故A正确;
,故A正确;
B.原子核内有10个中子的氧原子的质量数为18,其质子数为8,该氧原子可以表示为:![]() ,故B错误;
,故B错误;
C.漂白粉的有效成分是次氯酸钙,化学式为![]() ,故C错误;
,故C错误;
D.![]() 是强碱弱酸酸式盐,在水溶液中完全电离生成
是强碱弱酸酸式盐,在水溶液中完全电离生成![]() ,电离方程式为
,电离方程式为![]() ,故D错误;
,故D错误;
故选:A。

 阅读快车系列答案
阅读快车系列答案【题目】某研究性学习小组的同学在学习了二氧化碳与过氧化钠的反应后,对过氧化钠与二氧化硫的反应进行实验探究。
(1)提出假设:
假设1. 固体产物是Na2SO3
假设2. _________________________
假设3. 固体产物是Na2SO3和Na2SO4的混合物。
(2)实验验证:用如图所示装置对上述假设进行实验。
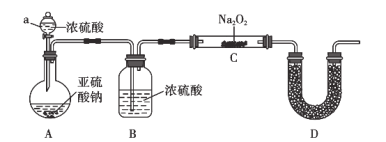
(1)仪器a的名称为__________,装置A中发生反应的化学方程式为:________________________。
(2)装置B的作用为________________________,装置D中试剂的名称为________。
(3)装置C中固体完全反应后,得到白色固体,进行如下实验。
实验操作 | 预期现象与结论 |
步骤1.取少量白色固体于试管中,加入足量的稀盐酸,将生成的气体通入品红溶液。 | 若_____________,说明白色固体中含有Na2SO3。 |
步骤2.在步骤1反应后的溶液中加入________ | 若_____________,说明白色固体中含有Na2SO4。 |
通过实验探究发现上述两个实验现象均有,则说明假设3正确。