题目内容
下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
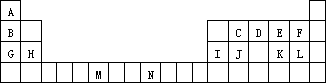
试回答下列问题:
(1)请写出元素N的基态原子电子排布式________.
(2)元素B、G形成的单质熔点更高的是________(填化学式),原因是________
(3)ME2 L2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断ME2 L2是________(填“极性”或“非极性”)分子.
(4)在①苯、②CH3OH、③HCHO、④CS2、⑤CCl4五种有机溶剂中,碳原子采取 sp2杂化的分子有________(填序号),CS2分子的空间构型是________.
(5)元素N可以形成分子式为Co(NH3)5BrSO4,配位数均为6的两种配合物,若往其中一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则该配合物的化学式为________.
答案:
解析:
解析:
|
(1)1s22s22p63s23p63d74s2或[Ar]3d74s2 (2)Li;Li和Na的价电子数相同,但Li原子半径小于Na原子半径,所以Li金属键更强,熔点更高 (3)非极性 (4)①③ 直线型 (5)[Co(NH3)5SO4]Br |

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目



 NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是
NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是 (4)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是
(4)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是