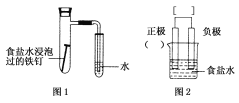
题目内容
【题目】依据氧化还原反应:Fe(s)+Cu2+(aq)=Fe2+(aq)+Cu(s)设计的原电池如图所示。

请回答下列问题:
(1)电极X的材料是________;电解质溶液Y是________。
(2)铜电极为电池的________极,发生的电极反应为_______________;X电极上发生的电极反应为__________________。
(3)外电路中的电子是从________电极流向________电极。
【答案】Fe CuSO4 正 Cu2++2e-=Cu Fe-2e-=Fe2+ Fe Cu
【解析】
根据原电池工作原理、结合反应方程式和装置图分析解答。
(1)含有盐桥的原电池中,电极材料和相对应的电解质溶液具有相同的金属元素,所以X电极材料为Fe,Y电解质溶液为CuSO4溶液;
(2)根据电池反应式知,Fe元素化合价由0价变为+2价,则Fe作负极,所以Cu作正极,正极Cu电极反应式为Cu2++2e-=Cu、X电极为负极,负极反应式为Fe-2e-=Fe2+;
(3)放电时,电子从负极Fe沿导线流向正极Cu。

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
【题目】已知反应H2(g)+ I2(g)![]() 2HI(g),1 mol H2完全反应放出a kJ的热量,依据下表数据,以下说法错误的是( )
2HI(g),1 mol H2完全反应放出a kJ的热量,依据下表数据,以下说法错误的是( )
化 学 键 | H—H | I—I |
断开1 mol化学键时吸收的能量(kJ) | b | c |
A.该反应中反应物的总能量高于生成物的总能量
B.断开1 mol H-H 键和1 mol I-I 键所需能量大于断开2 mol H-I 键所需能量
C.断开2 mol H-I键所需能量为(a+b+c)kJ
D.向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ