题目内容
16.下列实验操作正确且能达到预期目的是( )| 实验目的 | 操作 | |
| A | 检验淀粉水解产物有还原性 | 淀粉溶液和稀H2SO4混合加热,冷却后,再加新制的Cu(OH)2悬浊液加热至沸腾 |
| B | 证明SO2具有漂白性 | 将SO2通入溴水中 |
| C | 为了提取溴水中的溴 | 加入植物油进行萃取 |
| D | 浓、稀HNO3分别与Cu反应 | 比较浓、稀HNO3的氧化性强弱 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.水解后检验葡萄糖,应在碱性条件下;
B.SO2通入溴水中,发生氧化还原反应;
C.植物油含C=C,与溴水发生加成反应;
D.Cu与浓硝酸反应生成二氧化氮,Cu与稀硝酸反应生成NO,且反应的剧烈程度不同.
解答 解:A.水解后检验葡萄糖,应在碱性条件下,则水解后没有加碱,不能检验,故A错误;
B.SO2通入溴水中,发生氧化还原反应,与二氧化硫的还原性有关,与漂白性无关,故B错误;
C.植物油含C=C,与溴水发生加成反应,则不能作萃取剂,故C错误;
D.浓、稀硝酸的强氧化性不同,与铜反应的剧烈程度不同,浓硝酸氧化性较强,可与铜剧烈反应,能达到实验目的,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握有机物的性质、发生的反应、混合物分离提纯为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
19.质量相同的下列物质,含分子数最少的是( )
| A. | 氢气 | B. | 氧气 | C. | 氮气 | D. | 二氧化碳 |
20.下列说法正确的是( )
| A. | 铅蓄电池在放电过程中,负极质量增加,正极质量也增加 | |
| B. | 常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0 | |
| C. | 一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 | |
| D. | 相同条件下,溶液中Fe3+、Cu2+、Zn2+的氧化性依次减弱 |
4.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,2.24 L CCl4含有0.1 NA个CCl4分子 | |
| B. | 18gD2O含有的质子数为10NA | |
| C. | 标准状况下,2.24 L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA | |
| D. | 1.5molCu和足量稀硝酸反应产生NA个NO分子 |
11.化学在工农业生产和日常生活中都有着重要的应用.下列说法错误的是( )
| A. | 利用催化设施,可以将汽车尾气中CO和NO转化为无害气体 | |
| B. | 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 | |
| C. | 锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去 | |
| D. | 防止酸雨发生的重要措施之一是使用清洁能源 |
1.对下列实验过程的评价,正确的是( )
| A. | 某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐 | |
| B. | 验证溶液中是否含有Cl-,加稀硝酸酸化的AgNO3溶液,有白色沉淀,证明含Cl- | |
| C. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ | |
| D. | 某溶液中滴加盐酸酸化的BaCl2溶液,生成白色沉淀,证明一定含有SO42- |
8.某有机物的结构简式如图所示,下列有关该物质的叙述,正确的是( )
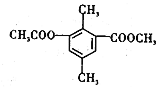

| A. | 分子中不同化学环境的氢共有4种 | |
| B. | 分子中所有的碳原子不可能共平面 | |
| C. | lmol该有机物与足量NaOH溶液反应,最多消耗3mol NaOH | |
| D. | 能发生取代、消去、加成和氧化反应 |
5.如图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略).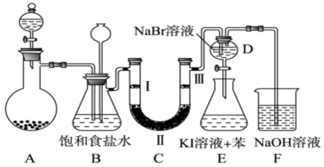
(1)固体二氧化锰和浓盐酸制备氯气的化学反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.装置B中饱和食盐水的作用是除去Cl2中的HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中锥形瓶水位下降,长颈漏斗中液面上升,形成水柱.
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入d.(填序号)
(3)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱.当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为橙黄色,说明Cl2氧化性>Br2(填>、<或=).打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象是E中溶液分为两层,上层(苯层)为紫红色.
(4)装置F中用足量的NaOH溶液吸收余氯,试写出相应的化学方程式2NaOH+Cl2=NaCl+NaClO+H2.

(1)固体二氧化锰和浓盐酸制备氯气的化学反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.装置B中饱和食盐水的作用是除去Cl2中的HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中锥形瓶水位下降,长颈漏斗中液面上升,形成水柱.
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入d.(填序号)
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)装置F中用足量的NaOH溶液吸收余氯,试写出相应的化学方程式2NaOH+Cl2=NaCl+NaClO+H2.
6.下列溶液一定呈中性的是( )
| A. | pH=7的溶液 | |
| B. | c(H+)=c(OH-)=10-6mol/L溶液 | |
| C. | 醋酸钠溶液 | |
| D. | 酸与碱恰好完全反应生成正盐的溶液 |