题目内容
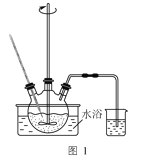
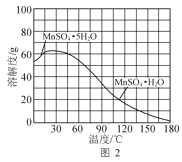
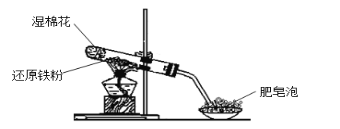
【题目】某同学利用下图的实验装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质。
请回答下列问题:
(1)图中湿棉花的作用是____________;硬质试管中发生反应的化学方程式为__________ 。
(2)该同学推测反应后硬质试管中固体物质的成分有两种可能性:ⅰ只有Fe3O4 ,ⅱFe3O4和Fe都有;并设计了如下实验方案验证:
①待硬质试管冷却后,将固体磨碎后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,溶液未变红色,则说明硬质试管中固体物质的成分是____。溶液未变红色的主要原因是:______(用离子方程式表示)。
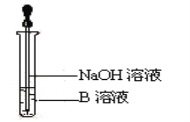
(3)该同学马上另取少量溶液B于试管中,按下图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出上述白色沉淀变成红褐色的化学方程式:_______。
(4)该同学向②的溶液中加入几滴氯水溶液变成红色,说明Fe2+具有______性。
【答案】提供水蒸气 3Fe+4H2O(g) ![]() Fe3O4+4H2 Fe3O4和Fe 2Fe3++Fe=3Fe2+ 4Fe(OH)2+O2+2H2O=4Fe(OH)3 还原
Fe3O4+4H2 Fe3O4和Fe 2Fe3++Fe=3Fe2+ 4Fe(OH)2+O2+2H2O=4Fe(OH)3 还原
【解析】
(1)硬质试管中中铁与湿棉花加热产生的水蒸气反应生成四氧化三铁和氢气;
(2)KSCN溶液遇Fe3+变红色,溶液未变红色,不变红色说明无Fe3+,铁单质能将+3价的Fe3+还原成+2价的Fe2+;
(3)溶液B中滴入NaOH溶液时,生成的白色沉淀迅速变成灰绿色,最后变成红褐色,说明溶液中含有Fe2+,首先生成Fe(OH)2白色沉淀,Fe(OH)2会被氧化产生红褐色的Fe(OH)3;
(4)向②的溶液中加入氯水,溶液变为红色,说明Fe2+被氯水氧化为Fe3+,Fe3+与SCN-反应产生红色物质。
(1)湿棉花上有水分,加热会产生水蒸气,与硬质试管中铁在高温下发生反应产生Fe3O4和H2,反应的方程式为:3Fe+4H2O(g) ![]() Fe3O4+4H2;
Fe3O4+4H2;
(2)①待硬质试管冷却后,将固体磨碎,取少许其中的固体物质溶于稀硫酸得溶液B;②取少量溶液B滴加KSCN溶液,溶液未变红色,则说明硬质试管中固体物质的成分是Fe3O4和Fe,溶液未变红色的主要原因是铁单质能将+3价的Fe3+还原成+2价的Fe2+,反应的离子方程为:Fe+2Fe3+=3Fe2+;
(3)向用硫酸溶解反应得到的固体后的溶液B中滴入NaOH溶液时,生成的白色沉淀,白色沉淀迅速变成灰绿色,最后变成红褐色,该反应为FeSO4+2NaOH=Fe(OH)2↓+Na2SO4;4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4)向②的溶液中加入氯水,溶液变为红色,说明Fe2+与氯水作用产生了Fe3+,Fe3+与SCN-反应产生红色物质,Fe元素由+2价变为+3价,化合价升高,失去电子,被氧化,因此Fe2+表现还原性。

【题目】下列实验操作完全正确的是()
编号 | 实验 | 操作 |
A | 用浓硫酸配制一定浓度的稀硫酸 | 准确量取浓硫酸,将浓硫酸溶于水后,立刻转移到容量瓶中。 |
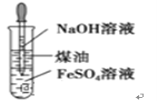
B | 制取氢氧化亚铁沉淀 |
|
C | 量取盐酸溶液 | 用50 mL量筒量取4.0 mol/L的盐酸5.62 mL |
D | 取出分液漏斗中所需的上层液体 | 下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出 |
A.AB.BC.CD.D