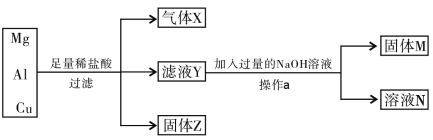
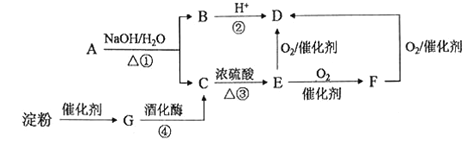
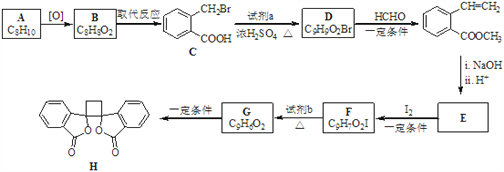
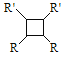
题目内容
【题目】用标准的盐酸滴定待测的氢氧化钠溶液时,可能使所测氢氧化钠溶液的浓度数值偏大的是( )
A.锥形瓶用蒸馏水洗净后没有干燥
B.碱式滴定管未用待测液润洗就直接注入待测氢氧化钠溶液
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始时仰视读数,滴定结束时俯视读数
【答案】C
【解析】
A、锥形瓶用蒸馏水洗净后没有干燥,氢氧化钠的物质的量不变,对消耗盐酸的体积无影响,所测![]() 无影响,故不选A;
无影响,故不选A;
B、碱式滴定管未用待测液润洗就直接注入待测氢氧化钠溶液,氢氧化钠的浓度偏小,物质的量偏小,消耗盐酸体积偏小,根据c(待测)=![]() 可知,所测
可知,所测![]() 偏小,故不选B;
偏小,故不选B;
C、酸式滴定管在滴定前有气泡,滴定后气泡消失,造成V盐酸偏大,根据c(待测)=![]() 可知,所测
可知,所测![]() 偏大,故选C;
偏大,故选C;
D、读取盐酸体积时,开始时仰视读数,滴定结束时俯视读数,造成V盐酸偏小,根据c(待测)=![]() 可知,所测
可知,所测![]() 偏小,故不选D;
偏小,故不选D;
答案选C。

【题目】Ⅰ、某温度下,HNO2和CH3COOH的电离常数分别为5.0×10-4和1.7×10-5。将pH和体积均相同的两种酸溶液分别加水稀释,其pH随加水体积的变化如图所示。

(1)曲线Ⅰ代表____溶液(填“HNO2”或“CH3COOH”,下同)。
(2)a点时,物质的量浓度较大的是______溶液。相同体积a点的两溶液分别与NaOH恰好中和后,溶液中n(Na+)较少的是_____。
(3)b、c两点溶液中水的电离程度较大的是___ (填“b”或“c”)。
(4)CH3COOH的稀释过程中,下列说法正确的是___ (填编号)。
a.CH3COOH的电离常数增大
b.H+的物质的量减小
c. ![]() 保持不变
保持不变
d. CH3COOH的电离程度增大,溶液的导电能力增强
Ⅱ、25℃,两种酸的电离平衡常数如表。
|
| |
H2A | 4.4×10-7 | 4.7×10-11 |
H2B | 1.3×10-7 | 7.1×10-15 |
(5)HA-的电离平衡常数表达式K =_______。
(6)0.10 molL-1 NaHB溶液中H+、OH-、Na+、HB-的浓度由大到小的顺序为_______。
(7)等浓度的四种溶液:a. Na2A、b. NaHA、c. Na2B、d. NaHB的pH由大到小顺序是_______(填字母)。