题目内容
【题目】氮化硅(Si3N4)是一种新型陶瓷材料,它由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g)![]() Si3N4(s)+6CO(g)。
Si3N4(s)+6CO(g)。
(1)该反应的平衡常数表达式为K=_________;
(2)若知上述反应为放热反应,则其反应热△H___0(填“>”、“<”或“=”);升高温度,其平衡常数值___(填“增大”、“减小”或“不变”);若已知CO生成速率为v(CO)=18molL﹣1min﹣1,则N2消耗速率为v(N2)=_____;
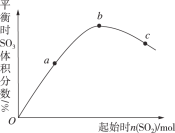
(3)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率v与时间t的关系如图.图中t4时引起平衡移动的条件可能是___;图中表示平衡混合物中CO的含量最高的一段时间是_____。

【答案】![]() < 减小 6mol/(Lmin) 升高温度或增大压强; t3﹣t4
< 减小 6mol/(Lmin) 升高温度或增大压强; t3﹣t4
【解析】
(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值;
(2)该反应为放热反应,升高温度,平衡向吸热的逆反应方向移动,化学平衡常数减小;由化学反应速率之比等于化学计量数之比计算可得;
(3)该反应是一个气体体积增大的放热反应,升高温度或增大压强,正逆反应速率都增大,平衡都向逆反应方向移动。
(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,则该反应的平衡常数表达式是K=![]() ,故答案为:
,故答案为:![]() ;
;
(2)该反应为放热反应,则反应热△H小于0;升高温度,平衡向吸热的逆反应方向移动,化学平衡常数减小;由化学反应速率之比等于化学计量数之比可知,N2消耗速率为v(N2)=![]() v(NO)=
v(NO)=![]() ×18mol·L-1·min-1=6 mol L-1min-1,故答案为:<;减小;6mol/(Lmin);
×18mol·L-1·min-1=6 mol L-1min-1,故答案为:<;减小;6mol/(Lmin);
(3)由图可知,t4时改变某一外界条件,正逆反应速率都增大,正反应速率小于逆反应速率,平衡向逆反应方向移动,该反应是一个气体体积增大的放热反应,升高温度或增大压强,平衡都向逆反应方向移动,则改变的条件可能是升高温度或增大压强;根据图像可知,从反应开始至t3时,反应一直是向正反应方向进行的,而从t4开始反应向逆反应方向进行,则表示平衡混合物中CO的含量最高的一段时间是t3~t4,故答案为:升高温度或增大压强;t3~t4。

 名校课堂系列答案
名校课堂系列答案【题目】绿矾(FeSO4·7H2O)外观为半透明蓝绿色单斜结晶或颗粒,无气味。受热能分解,且在空气中易被氧化。
I.医学上绿矾可用于补血剂甘氨酸亚铁[(NH2CH2COO)2Fe]颗粒的制备,有关物质性质如下:
甘氨酸(NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇,两性化合物 | 易溶于水和乙醇,有强酸性和还原性 | 易溶于水,难溶于乙醇 |
(1)向绿矾溶液中,缓慢加入NH4HCO3溶液,边加边搅拌,反应结束后生成沉淀FeCO3。该反应的离子方程式为_______。
(2)制备(NH2CH2COO)2Fe:往FeCO3中加入甘氨酸(NH2CH2COOH)的水溶液,滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。
①加入柠檬酸溶液一方面可调节溶液的pH促进FeCO3溶解,另一个作用是__。
②洗涤操作,选用的最佳洗涤试剂是_______(填序号)。
A.热水 B.乙醇 C.柠檬酸
II.绿矾晶体受热分解的反应为2FeSO4·7H2O![]() Fe2O3+SO2↑+SO3↑+14H2O,实验室用图I所示装置验证其分解产物。请回答下列问题:
Fe2O3+SO2↑+SO3↑+14H2O,实验室用图I所示装置验证其分解产物。请回答下列问题:
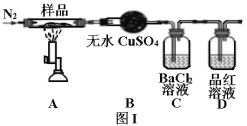
(1)加热前通入氮气的目的是_______。
(2)实验中观察到装置B现象为_______。
(3)C装置和D装置能否调换_______(填“能”或“否”)。
(4)样品完全分解后,残留物全部为红棕色固体,检验装置A中的残留物含有Fe2O3的方法是_______。
(5)该装置有个明显缺陷是_______。
III.测定绿矾样品中铁元素的含量。
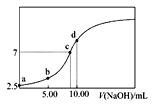
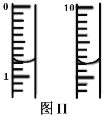
称取m g绿矾样品于锥形瓶中溶解后加稀H2SO4酸化,用 c mol·L1 KMnO4 溶液滴定至终点。耗KMnO4溶液体积如图II所示,(滴定时发生反应的离子方程式为:5Fe2++MnO4+8H+=5Fe3++Mn2++4H2O),该晶体中铁元素的质量分数为_______(用含m、c的式子表示)。