题目内容
10.下列性质可以证明某化合物内一定存在离子键的是( )| A. | 可溶于水 | B. | 水溶液能导电 | C. | 熔融状态可导电 | D. | 熔点350℃ |
分析 某种化合物中一定存在离子键,说明该化合物中是离子化合物,离子化合物在熔融状态下能导电,共价化合物在熔融状态下不能导电,据此分析解答.
解答 解:某种化合物中一定存在离子键,说明该化合物中是离子化合物,离子化合物在熔融状态下能导电,共价化合物在熔融状态下不能导电,
A.可溶于水的化合物可能是共价化合物,如HCl,故A错误;
B.水溶液能导电的化合物可能是共价化合物,如二氧化硫等,故B错误;
C.熔融状态下可导电的化合物中含有自由移动的阴阳离子,所以该化合物的构成微粒是阴阳离子,为离子化合物,一定含有离子键,故C正确;
D.熔点350℃可能是共价化合物,故D错误;
故选C.
点评 本题考查离子化合物的判断,侧重考查基本概念,明确离子化合物和共价化合物的根本区别是解本题关键,注意不能根据溶解性、电解质溶液酸碱性及导电能力强弱判断离子化合物,为易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.资料显示:
a.Na2S2O3、BaS2O3、BaS均易溶于水.
b.SO2、Na2S、Na2CO3反应可生成Na2S2O3.
某化学小组据此进行了制备硫代硫酸钠(Na2S2O3)的探究,实验制备装置如图所示(省略夹持装置):

回答问题:
(1)仪器a的名称是分液漏斗.
(2)装置A中发生反应的化学方程式是Na2SO3+H2SO4=Na2SO4+SO2↑+H2O.
(3)装置B的作用之一是观察SO2的生成速率.
①B中最好盛装的液体是c.
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
②如使SO2缓慢进入烧瓶C,正确的操作是控制分液漏斗的活塞,使浓硫酸缓慢滴入A中.
(4)在装置C中生成Na2S2O3.
①完成反应方程式:4SO2+2Na2S+1Na2CO3=3Na2S2O3+CO2
②反应开始先使A中发生反应一会儿,再使C中反应发生,其原因是A中反应一会生成二氧化硫,C中才能反应.
③结束反应后,取C中溶液,经蒸发、结晶、过滤、洗涤、干燥、得到Na2S2O3•5H2O.
(5)完成对所得产品的检测的实验:
a.Na2S2O3、BaS2O3、BaS均易溶于水.
b.SO2、Na2S、Na2CO3反应可生成Na2S2O3.
某化学小组据此进行了制备硫代硫酸钠(Na2S2O3)的探究,实验制备装置如图所示(省略夹持装置):

回答问题:
(1)仪器a的名称是分液漏斗.
(2)装置A中发生反应的化学方程式是Na2SO3+H2SO4=Na2SO4+SO2↑+H2O.
(3)装置B的作用之一是观察SO2的生成速率.
①B中最好盛装的液体是c.
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
②如使SO2缓慢进入烧瓶C,正确的操作是控制分液漏斗的活塞,使浓硫酸缓慢滴入A中.
(4)在装置C中生成Na2S2O3.
①完成反应方程式:4SO2+2Na2S+1Na2CO3=3Na2S2O3+CO2
②反应开始先使A中发生反应一会儿,再使C中反应发生,其原因是A中反应一会生成二氧化硫,C中才能反应.
③结束反应后,取C中溶液,经蒸发、结晶、过滤、洗涤、干燥、得到Na2S2O3•5H2O.
(5)完成对所得产品的检测的实验:
| 推测 | 操作和现象 | 结论 |
| 杂质中的正盐成分可能有: Na2S Na2CO3 Na2SO3 Na2SO4 | ①取Wg产品配成稀溶液; ②向溶液中滴加过量BaCl2溶液,有白色沉淀生成,过滤,得沉淀和滤液; ③向沉淀中加入过量盐酸,沉淀完全溶解,并有刺激性气味的气体产生. ④向滤液滴加2滴淀粉溶液,再逐滴加0.100 0mol•L-1碘的标准溶液,至溶液呈紫色不再褪去,消耗碘的标准溶液体积为18.10mL. | 产品杂质中: 一定含有Na2SO3, 可能含有Na2S、Na2CO3, 一定不含有Na2SO4. 操作④发生的反应是: 2S2O${\;}_{3}^{2-}$+I2═S4O${\;}_{6}^{2-}$+2I- 产品纯度:$\frac{9}{w}$×100%. |
18.下列反应中,反应后固体物质增重的是( )
| A. | 氢气通过灼热的CuO粉末 | B. | 碳与SiO2高温反应制粗硅 | ||
| C. | 将锌粒投入Cu(NO3)2溶液 | D. | 镁条在CO2中燃烧 |
5.设NA为阿伏加德罗常数,下列叙述中正确的是( )
| A. | 常温下,11.2L的甲烷气体含有甲烷分子数为0.5 NA | |
| B. | 14g乙烯和丙烯的混合物中总原子数为3 NA | |
| C. | 标准状况下,22.4 L氯仿中含有的氯原子数目为3 NA | |
| D. | 17.6 g丙烷中所含的极性共价键为4 NA |
15.分子式为C8H18的烷烃中,含有4个甲基的同分异构体的数目是( )
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
2.以下化学用语正确的是( )
| A. | 一CH3(甲基)的电子式为 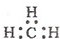 | B. | 硝基苯的结构简式: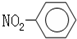 | ||
| C. | 甲醛的结构式: | D. | 乙醇的分子式:CH3CH2OH |
20.下列是氧化还原也是吸热反应的是( )
| A. | 灼热的炭与二氧化碳反应 | |
| B. | 铁和稀硫酸的反应 | |
| C. | 氢氧化钡晶体的粉末和氯化铵晶体混合 | |
| D. | 生石灰溶于水 |
 利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖.
利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖.