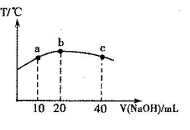
题目内容
A、B、C、D是元素周期表前三周期中的4种元素,A能与D组成AD2型化合物,AD2中核外电子总数是30,D-的核外电子排布与Al3+相同;B和C可以形成BC型化合物,BC分子中质子总数是18,BC水溶液是一种强酸,试回答:
(1)写出上述四种元素的名称:A__________,B__________,C__________,D__________。
(2)用电子式表示AD2:___________________________________ _____________________________________。
(3)D单质与水反应的化学方程式为_________________________ __________________________________________。
(1)镁 氢 氯 氟
(2)
(3)2F2+2H2O=4HF+O2
解析

练习册系列答案
相关题目
标号为①~⑩的元素,在元素周期表中的位置如下:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 1 | ① | | | | | | | ② |
| 2 | | | | ③ | ④ | ⑤ | ⑥ | |
| 3 | ⑦ | ⑧ | | | | ⑨ | ⑩ | |
试回答下列问题:
(1)其原子只要形成一对共用电子对就达到了稳定结构的元素是________。(填写元素符号)
(2)①和④号元素形成的化合物的化学式为________,用电子式表示其形成过程为________。
(3)⑧号元素的最高价氧化物的水化物的化学式是____________________。
(4)①、⑤、⑦号元素形成的一种化合物的电子式是________,在该化合物中既含有________键,又含有________键。

 乙
乙 丙,若其中甲是单质,乙、丙为化合物,x是具有氧化性的无色气体单质,则甲的化学组成不可能是________(选填序号,下同)。
丙,若其中甲是单质,乙、丙为化合物,x是具有氧化性的无色气体单质,则甲的化学组成不可能是________(选填序号,下同)。