题目内容
5.下列性质中,可以证明某化合物形成的晶体一定是离子晶体的是( )| A. | 可溶于水 | B. | 具有较高的熔点 | C. | 水溶液能导电 | D. | 熔融状态能导电 |
分析 熔融状态下能导电的化合物是离子晶体,分子晶体或原子晶体在熔融状态下不导电,据此分析解答.
解答 解:A.可溶于水的化合物晶体不一定是离子晶体,如HCl等,故A错误;
B.具有较高熔点的化合物晶体不一定是离子晶体,如二氧化硅等,故B错误;
C.水溶液能导电的化合物晶体不一定是离子晶体,如醋酸、硫酸等,故C错误;
D.熔融状态下能导电的化合物晶体中含有阴阳离子,所以一定是离子晶体,故D正确;
故选D.
点评 本题考查离子晶体的判断,侧重考查学生分析判断能力,共价化合物和离子化合物可以通过熔融状态是否导电判断,注意不能根据溶解性、熔沸点及水溶液的导电性判断离子晶体,为易错点.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
15.反应A+3B═2C+2D 在四种不同条件下的反应速率为:( )
(1)v(A)=0.3mol/(L•s )
(2)v(B)=0.6mol/(L•s)
(3)v(C)=0.4mol/(L•s)
(4)v(D)=0.45mol/(L•s)
(1)v(A)=0.3mol/(L•s )
(2)v(B)=0.6mol/(L•s)
(3)v(C)=0.4mol/(L•s)
(4)v(D)=0.45mol/(L•s)
| A. | (4)>(1)>(2)=(3) | B. | (2)>(1)>(4)=(3) | C. | (1)>(4)>(2)=(3) | D. | (3)>(4)>(2)=(1) |
16.下列各项中表达正确的是( )
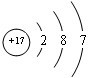
| A. | N2的结构式::N≡N: | B. | F-离子结构示意图: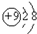 | ||
| C. | 用电子式表示HCl形成过程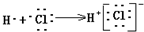 | D. | 次氯酸电子式 |
13.下列关于实验现象的描述正确的是( )
| A. | 把铜片和铁片紧靠在一起浸入稀硫酸中,铁片表面出现气泡 | |
| B. | 用锌片做阳极铁片做阴极,电解氯化锌溶液,铁片表面出现一层锌 | |
| C. | 把铜片插入三氯化铁溶液中,在铜片表面出现一层铁 | |
| D. | 把少量锌粒放入盛有足量的盐酸试管中,加几滴氯化铜溶液,气泡放出速率加快,生成氢气的总量不变 |
17.常温下,下列各组离子在指定溶液中一定能大量共存或离子方程式正确的是( )
| A. | 0.1mol•L-1Fe(NO3)2溶液:Mg2+、H+、SO${\;}_{4}^{2-}$、Cl- | |
| B. | 常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、AlO${\;}_{2}^{-}$、CO${\;}_{3}^{2-}$、Na+ | |
| C. | Na2O2溶于水产生O2:2O22-+2H2O═O2↑+4OH- | |
| D. | 用过氧化氢从酸化海带灰浸出液中提取碘:2I-+H2O2═I2+2OH- |

 .
.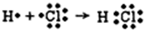 .
.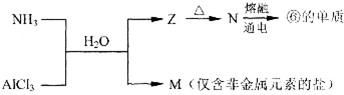
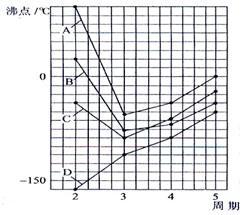 如图四条曲线分别表示ⅣA、VA、ⅥA、ⅦA族元素的气态氢化物的沸点,曲线A、B、C、D表示的气态氢化物(写化学式)分别是H2O,HF,NH3,CH4,同一族中第3、4、5周期元素的气态氢化物沸点依次升高,其原因a同一族中第4、5周期元素气态氢化物都不含氢键且分子间作用力大于第三周期氢化物.曲线A、B、C中第2周期元素的气态氢化物的沸点显著高于第3周期元素气态氢化物的沸点,其原因b第二周期元素的氢化物分子间存在氢键.
如图四条曲线分别表示ⅣA、VA、ⅥA、ⅦA族元素的气态氢化物的沸点,曲线A、B、C、D表示的气态氢化物(写化学式)分别是H2O,HF,NH3,CH4,同一族中第3、4、5周期元素的气态氢化物沸点依次升高,其原因a同一族中第4、5周期元素气态氢化物都不含氢键且分子间作用力大于第三周期氢化物.曲线A、B、C中第2周期元素的气态氢化物的沸点显著高于第3周期元素气态氢化物的沸点,其原因b第二周期元素的氢化物分子间存在氢键. ,B的结构简式
,B的结构简式 或
或 .
. ,
, 、
、 、
、 、
、 .
. NH4+
NH4+
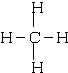 ; CO2O=C=O
; CO2O=C=O I.
I.